Lo scopo di questa lezione è quello di “ripassare” ovvero conseguire una conoscenza rapida, ma superficiale dei 3 argomenti. Pertanto avete i link corrispondenti all’inizio dell’argomento e molte immagini le ho rimosse per praticità, così come le preziose etimologie, che amo molto e che vi ho insegnato ad amare.
MODULO n. 23, lezione n. 47
Riassunto, cenni sulle lezioni: Batteri, Virus, Miceti.
BATTERI: ORGANIZZAZIONE della lezione per TEMI:
Introduzione
Ambiente
Forme
Dimensioni
Struttura
Produzione di energia
Nutrizione
Riproduzione batterica
Modalità di ingresso nell’Uomo
Virulenza
Esotossine
Superantigeni
Anatossine
Endotossine
Citochine
Antibiotici (cenni).
INTRODUZIONE. Batterio, con sinonimo germe e monèra (obsoleto).
Con il termine di microbo o microbio, si intendono vari elementi biologici con, oltre i batteri, procarioti anucleati, i virus, i citomegalovirus (derivati dalla famiglia dell’Herpes che determinano un > patologico del volume delle cellule colpite) ed altri microrganismi patogeni unicellulari come i protozoi (dal Gr. proto, primo e zoarion, animaluccio), organismi unicellulari eucarioti, cioè con nucleo.
I batteri (BB) sono anche amici, come descritto nella lezione n. 30 del modulo 11: Il MICROBIOTA INTESTINALE.
I BB unicellulari, procarioti, cioè senza nucleo come detto ma comunque provvisti di “gomitoli di DNA”, sono presenti ovunque ed in gran quantità, tanto che gran parte della biomassa terrestre è da loro costituita.
Nel nostro corpo, sulla cute e negli organi che sono in relazione con l’esterno, cioè apparato respiratorio, uro-genitale ed apparato digerente, ma soprattutto nel grosso intestino (colon e crasso sono sinonimi), il peso complessivo dei batteri è di circa Kg 1.500.
AMBIENTE. Ovunque! Dentro di noi ed al di fuori di noi, nella terra, nell’acqua, nelle piante, negli animali, nei rifiuti radioattivi, nelle profondità della crosta terrestre e degli oceani (fino a 10.000 m. di profondità), nel ghiaccio artico, nei ghiacciai, nelle sorgenti calde e caldissime (200°C.), nella stratosfera, tra i 9.660 Km. ed i 48.000 Km.
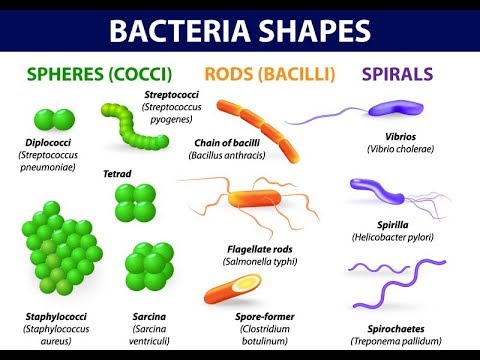
FORME: si presentano con tre aspetti:
la sferica: i cocchi;
a bastoncino retto: i bacilli, come il Mycobacterium tubercolosis e il bacillus anthracis ed
a bastoncino curvo, detti vibrioni come il Vibrio cholerae;
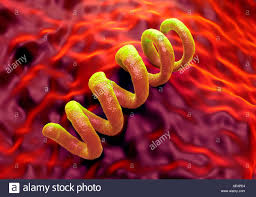
a spirale: le spirochete (a spirali multiple) come il treponema pallidum della sifilide (o lue), la Leptospira della leptospirosi classica o ittero-emorragica di Weil e la Borrelia burgdorferi (malattia di Lyme), e
gli spirilli (a due o più spirali) come il Campilobacter e l’Helicobacter.
DIMENSIONI. Il micrometro corrisponde a un millesimo di mm., mentre per i virus parliamo di nanometri, nm, cioè di 1 milionesimo di mm.. Le dimensioni dei BB variano da circa 0,2 µm dei micoplasmi, privi di parete cellulare, al Thiomargharita della Namibia, visibile ad occhio nudo per il suo diametro di circa 0,7 millimetri.
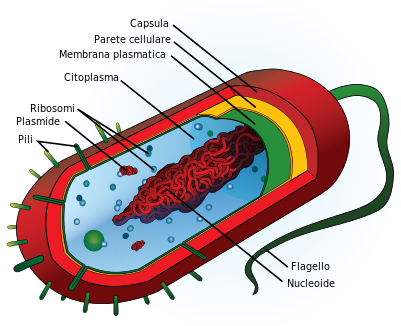
STRUTTURA. La sua parte più esterna è detta capsula o glicocalice, di natura saccaridica, protegge il germe dalla fagocitosi, ma Brucelle, Micobatteri, Stafilococchi, Salmonelle resistono all’interno delle cellule fagocitarie! Vi è quindi la
parete batterica, struttura rigida di supporto strutturale composta dal peptidoglicano, un polimero glicoproteico, solida impalcatura della membrana cellulare con funzioni di difesa anche qui contro la fagocitosi e regola lo scambio di metaboliti con il mondo esterno ed infine la
membrana citoplasmatica, con fosfolipide all’interno, lipopolisaccaride (LPS) all’esterno al quale è legata l’attività di endotossina (vedi avanti), caratteristica dei Gram- ed al suo interno troviamo il
citoplasma, sostanza gelatinosa che consente di ricavare energia da varie reazioni specifiche, contiene il materiale genetico, cioè il DNA di aspetto filamentoso con le istruzioni genetiche utilizzate nello sviluppo e nella funzione del batterio ed i
ribosomi, responsabili della sintesi proteica, particelle complesse costituite da granuli ricchi di RNA.
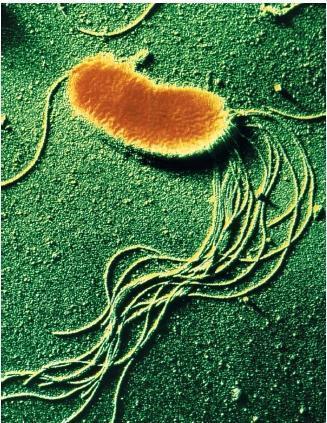
All’esterno della parete batterica, troviamo i flagelli e le fimbrie o pili, sinonimo.
Flagelli o ciglia. Molte specie batteriche sono mobili per mezzo del flagello, che sembra avere funzione anche di virulenza e adesività.
Fimbrie o pili: sono strutture esterne, come i flagelli, contribuiscono molto alla diversità morfologica delle cellule batteriche e sono coinvolte in diverse funzioni fisiologiche, come il trasferimento di acidi nucleici ad altre cellule, l’adesione batterica alle cellule ospiti epiteliali delle mucose con la loro colonizzazione e l’inganno del sistema immunitario.
Colorazione GRAM: dipende dalla tipologia della struttura della parete batterica.
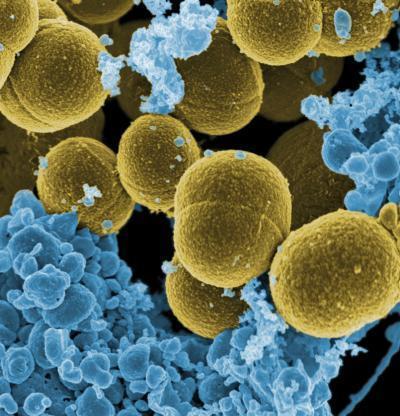
GRAM+ perché i germi prendono la colorazione blu-viola della procedura come tutti i Cocchi, tipo Staphylococcus aureus, streptococchi e pneumococchi ed il Clostridium tetani, tranne il gonococco ed il meningococco che sono GRAM-. Caratteristica degli ultimi lustri è la loro antibiotico-resistenza (link), come lo Staphylococcus aureus resistente alla meticillina (MRSA) e l’Escherichia Coli resistente ai beta-lattamici.
Invece i batteri GRAM- non assumono la colorazione GRAM, rimanendo color rosa. La loro parete cellulare è composta sempre dal peptidoglicano, molto sottile. Alcuni sono commensali cioè microrganismi “tranquilli”, non patogeni presenti nella normale flora intestinale, ma in casi particolari possono creare infezioni o favorire
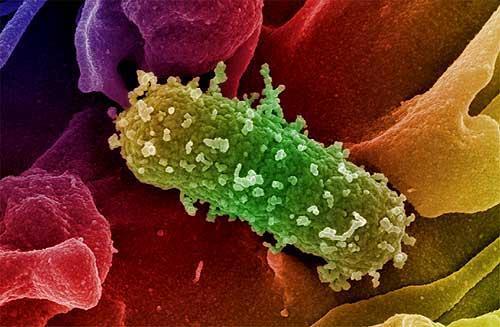
lo sviluppo di germi patogeni “dormienti”. Le loro infezioni, meno frequenti di quelle da GRAM+, di solito sono più gravi, ricordando il colera (Vibrio cholerae), la peste (Yersinia pestis), la meningite da meningococco (Neisseria meningitidis), la gonorrea (Neisseria gonorrheae) ed il tifo (Salmonella enterica), nonché infezioni delle vie urinarie, intestinali e di complicanze peritonitiche e setticemiche con lo Pseudomonas aeruginosa e l’Escherichia Coli.
PRODUZIONE di ENERGIA per la vita. I BB autotrofi producono energia attraverso la
fotosintesi (fotoautotrofi), usando luce solare, H2O e CO2, ricordando la “formula della vita al contrario”:
acqua (H2O) + anidride carbonica (CO2) + (E. sole) = glucosio (C6H12O6) + ossigeno (O2)
o con la
chemiosintesi (chemioautotrofi), servendosi di CO2, H2O e sostanze chimiche come azoto, zolfo, ammoniaca ed altri. Nei primi troviamo vegetali terrestri, alghe, fitoplancton ed i cianobatteri,
produttori di O2 che probabilmente sono all’origine della vita, immettendolo nell’ambiente terrestre; nel secondo gruppo si trovano BB che riescono a crescere ricavando energia tramite l’ossidazione (perdita di un atomo di idrogeno) di composti del mondo minerale in ambienti privi di ossigeno, di radiazione solare e di materia organica, come i batteri nitrificanti, i solfobatteri e gli archeobatteri metanogeni.
I batteri aerobi crescono solo dove c’è ossigeno. Per il ricavo dell’energia si può parlare anche qui di respirazione cellulare, cioè in rapporto alla presenza di ossigeno, dal quale si ricava energia (ATP). Essi possono provocare coliti muco-emorragiche e necrotizzanti spesso fatali, gas (meteorismo), gangrena (infezione anaerobica di tessuto necrotico), tetano (dal Clostridium tetani), botulismo (dal GRAM+ Clostridium botulinum) sporigeno e la maggior parte delle parodontopatie (infezioni dentali).
La NUTRIZIONE: garantita la “benzina”, cioè l’energia come ATP che consente di vivere espletando le specifiche reazioni biochimiche, vediamo ora le loro modalità di nutrizione: la stragrande maggioranza dei batteri appartiene al gruppo degli eterotrofi che può essere suddiviso in due grandi categorie, quella dei batteri saprofiti (che si cibano di materie vegetali e animali in via di decomposizione) e dei batteri parassiti (che si nutrono utilizzando il metabolismo di altri animali colonizzati). Per l’Uomo, utile questa classificazione: simbionti, a noi utili, commensali o saprofiti o indifferenti, opportunisti che possono diventare patogeni in determinate condizioni (solo in pazienti compromessi o se i germi vengono introdotti con procedure invasive) ed infine patogeni, capaci cioè di creare uno stato di malattia superando le difese immunitarie dell’organismo con compromissione del suo metabolismo.
Fissazione dell’azoto. I batteri assorbono azoto e quando muoiono lo rilasciano per l’impiego delle piante che ne hanno bisogno nel terreno per vivere.
RIPRODUZIONE BATTERICA: le modalità.
Fissione binaria: forma asessuale di riproduzione, nella quale una cellula continua a crescere fino a quando una nuova parete cellulare cresce dal centro, formando due cellule che si separano mantenendo lo stesso materiale genetico.
Trasferimento di materiale genetico: le cellule acquisiscono nuovo materiale genetico attraverso tre processi noti come (fonte):
coniugazione: trasferimento genico unidirezionale che richiede un contatto “fisico” tra due batteri: è il principale meccanismo di trasferimento di: geni per l’antibiotico-resistenza, geni codificanti per fattori di virulenza come (fonte) le enterotossine, esotossine proteiche prodotte da alcuni particolari ceppi
batterici GRAM+ come stafilococchi, vibrioni, clostridi ed altri, ad azione ovviamente tossica a livello della mucosa gastrointestinale, le adesine (fonte) anch’esse esostossine proteiche che si proiettano alla superficie del batterio consentendogli di aderire agli epiteli mucosi, colonizzandoli ed ancora l’enterobactina della famiglia dei siderofori (fonte), piccole molecole peculiari dei GRAM- e funghi, con elevata affinità per il ferro che viene chelato (reazione che ne impedisce l’assorbimento intestinale), con resistenza ad erbicidi, idrocarburi aromatici, metalli pesanti. La coniugazione rappresenta il principale meccanismo evolutivo/adattativo batterico; nei GRAM+ si ha la produzione e rilascio di ferormoni da parte della cellula “ricevente o accettrice” o femminile che inducono la produzione di una sostanza «aggregante» alla superficie della cellula “donatrice”, maschile, con formazione di aggregati cellulari e trasferimento del plasmide coniugativo;
trasformazione: (fonte) meccanismo di trasferimento genetico “evoluto” da una primitiva esigenza nutrizionale ed assunzione di frammenti di DNA solubile dall’ambiente circostante da parte di cellule batteriche “competenti”; con la trasformazione/donazione, il batterio donatore muore e si degrada. Anche qui, come per la coniugazione, è un meccanismo di trasferimento di geni per l’antibiotico-resistenza, per il trasferimento di geni codificanti per fattori di virulenza (enterotossine, adesine, siderofori), per il clonaggio di geni “utili” e per l’evoluzione/adattamento batterico;
trasduzione (fonte) consiste nel trasferimento di frammenti di DNA cromosomiale tra due batteri mediante un batteriofago,virus in grado di infettare elettivamente la cellula batterica. Quindi morte per lisi del batterio e rilascio dei fagi nell’ambiente dove attaccano un batterio sensibile iniettandovi il proprio genoma: il ciclo continua.
Questi tre complessi processi possono rendere i batteri più aggressivi, più forti e più capaci di resistere ad ambienti non favorevoli ed alle minacce, come gli antibiotici e possono ovviamente concludersi con la integrazione del DNA donatore in quello della cellula ricevente come ricombinazione genica.
Stiamo parlando della riproduzione batterica e continuiamo con le
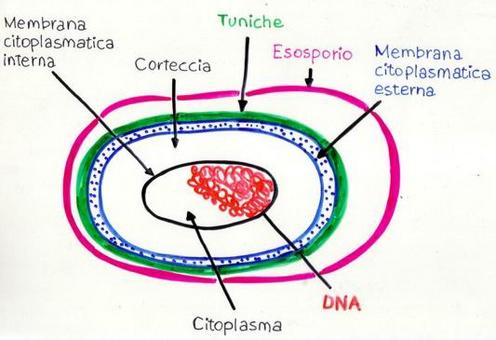
SPORE: sono cellule a tutti gli effetti, sia GRAM+ che G.-, specializzate per la resistenza, ma inattive, con vita latente in disidratazione, come i semi delle piante.
Le spore trattengono il materiale del DNA e gli enzimi necessari per la germinazione, acquisiscono resistenza agli stress ambientali rimanendo inattive anche per secoli, fino a quando le giuste condizioni ambientali le riattivino per (ri)diventare batteri. Alcuni batteri producono endospore, o spore interne come il Clostridio, mentre altri producono esospore, rilasciate all’esterno. Esistono circa 100 specie di Clostridium, tra i quali il botulinum, responsabile di un tipo potenzialmente letale di intossicazione alimentare, il Cl. Tetani, il Cl. difficile, che causa coliti ma anche colite emorragica talora letale in corso di antibioticoterapia non supportata da somministrazione di adeguati fermenti lattici (patologia “fai da te” o iatrogena!) ed il C. perfrigens che provoca gangrena gassosa (gas di CO2, H+ ed acido solfidrico) con colliquazione dei tessuti, muscolari ed aponeurotici spesso nell’area ano-genitale, nelle incisioni chirurgiche e nelle lesioni traumatiche complesse “aperte”, spesso mortali.
MODALITA’ di INGRESSO nell’UOMO: ben descrittiva in questa immagine per alcuni gruppi importanti di germi.

Le TOSSINE.
Sono antigeni per lo più di natura proteica formati da piccoli e brevi singoli frammenti di DNA o RNA presenti in particolari batteri patogeni e sono di solito liberate dall’organismo dalla lisi (disgregazione della composizione biochimica della membrana cellulare e quindi sua rottura, da agenti biologici tipo enzimi, chimici e fisici), ma alcune sono eliminate con le vescicole ricche di proteine della membrana esterna nelle vescicole.
La loro VIRULENZA, cioè la capacità di provocare nell’ospite manifestazioni patologiche di varia entità supportate dalla replicazione batterica e dalla diffusione locale è di natura multifattoriale e per definizione una tossina innesca un processo distruttivo in vario modo, singolarmente come danno o con più fenomeni dannosi associati:
– inibisce la sintesi proteica (tossina difterica);
– attivano le risposte immunitarie;
– danneggiano l’ospite nel sito di infezione o lontano dal loro ingresso (la tossina tetanica ed in misura minore, la tossina botulinica, ascendono assoni e colpiscono strutture neurologiche distanti) configurando la colonizzazione dell’ospite;
– agiscono come dispositivi molecolari autonomi combinandosi con recettori specifici sulla membrana superficiale, alterandone la sua funzione (come nell’Escherichia Coli);
– penetrano nella cellula praticando “pori” inserendosi come un’elica;
– possono ancora modificare componenti intracellulari di cellule specifiche di un organismo. Tutto ciò provoca permeabilità della membrana cellulare, squilibrio idro-ionico e morte della cellula.
Tra le 315 tossine proteiche indotte da batteri GRAM+ e GRAM-, circa 50 sono attualmente considerate responsabili delle manifestazioni patologiche, e come visto, talora letali.
Le tossine batteriche si descrivomo in due grandi gruppi, funzione della loro liberazione dal corpo batterico, detta anche espressione biologica: ESOTOSSINE ed ENDOTOSSINE e a seconda dell’organo bersaglio caratteristico in enterotossine, neurotossine, citotossine, leucocidine ed (emo)lisine, qui con enzimi colliquativi che generano gangrena. Di queste, quella botulinica, è la più tossica al mondo.
Un’importante tossina non proteica è il lipopolisaccaride (LPS), un’endotossina componente della parete cellulare dei batteri GRAM- che vedremo più avanti.
ESOTOSSINE: sono proteine extracellulari diffusibili, peculiari di ogni batterio dal punto di vista biologico e patogeno, diversamente dalle endotossine.
Resistenti all’invecchiamento ed alla disidratazione, ma termolabili sono prodotte dai germi Gram+ che promuovono un’azione dannosa sia nel luogo di ingresso che nei siti colonizzati dove si replicano. La cellula bersaglio può essere unica, come il neurone per le tossine del tetano e del botulino, ovvero estesa ad elementi cellulari di vari organi, tessuti ed apparati come avviene con clostridi,
streptococchi, stafilococchi ed altri.
Il loro alto potere antigenico riconosciuto dai Linfociti B le rende vulnerabili agli anticorpi (sinonimo immunoglobuline, lo ricordo spesso) e sono anche trasformabili in anatossine (vedi avanti).
I più importanti batteri patogeni produttori di esotossine sono: i batteri del genere Clostridium responsabili del tetano, del botulismo e della gangrena gassosa, il Corynebacterium diphteriae, responsabile della difterite, gli stafilococchi produttori della tossina alfa, con espressione di emolisi e necrotizzante, alcuni ceppi di streptococchi beta-emolitici del gruppo A, classici delle tonsilliti e del reumatismo articolare acuto della prima metà del ‘900 (con severa compromissione sia renale glomerulare che della valvola mitralica, spesso fatali in giovani adulte/i), produttori di emolisine e della tossina causa dell’eruzione eritematosa della scarlattina, il bacillo di Shiga, Shigella dysenteriae della dissenteria bacillare, unico G-, già detto, produttore di tossina necrotizzante a carico della mucosa del colon.
Due i meccanismi d’azione: (fonte): fenomeni che vedremo anche per le endotossine:
– azione tossica sulla membrana cellulare (come abituale per il Clostridium Perfrigens) con conseguente distruzione della cellula ospite e l’ingresso con la
– penetrazione nella membrana citoplasmatica formando pori o canali (già prima nominati in VIRULENZA, con fuoriuscita di nutrienti e lisi della cellula come, ad esempio clinico, avviene per un’emolisina dello Streptococco e per quelle dello Stafilococco.
DENOMINAZIONE delle ESOTOSSINE: possono interessare l’intero organismo, pantrope con la caratteristica di inibire la sintesi proteica dell’elemento cellulare aggredito. Lo vediamo con le
emolisine citolitiche che aggrediscono caratteristicamente soltanto le cellule di alcuni distretti;
enterotossiche soprattutto per le cellule mucosali del piccolo intestino con vomito e diarrea per disregolazione talora mortale degli scambi idro-elettrolitici come per il Vibrione del colera, il Clostridium perfrigens, l’Escherichia Coli, gli Enterobatteri, alcuni Stafilococchi e la Yersinia enterocolitica;
neurotrope: sono due, quella botulinica e quella tetanica. La prima attacca i neuroni del SNP inibendo la liberazione dell’acetilcolina a livello della giunzione neuromuscolare con paralisi flaccida, quale tossinfezione alimentare determinata da un batterio Gram+ anaerobio obbligato, il Clostridium botulinum che può contaminare alimenti con morte per ipossia ipossica (modulo n. 3). La seconda, l’esotossina tetanica citolitica, attacca invece il SNC con blocco della liberazione dei neurotrasmettitori inibitori e quindi paralisi spastica;
citotossiche o citolitiche o citolisine o tossina emolitica: già visto che sono pantrope, formano pori con alterazione del citoplasma. Ne sono esempi quelle dello Stafilococco aureus agente nelle tossinfezioni alimentari, le emolisine, con lisi cardiotossica dei globuli rossi ed ancora la streptolisina, la suddetta tetanolisina, l’emolisina stafilococcica e la emolisina dell’Escherichia Coli. Altre
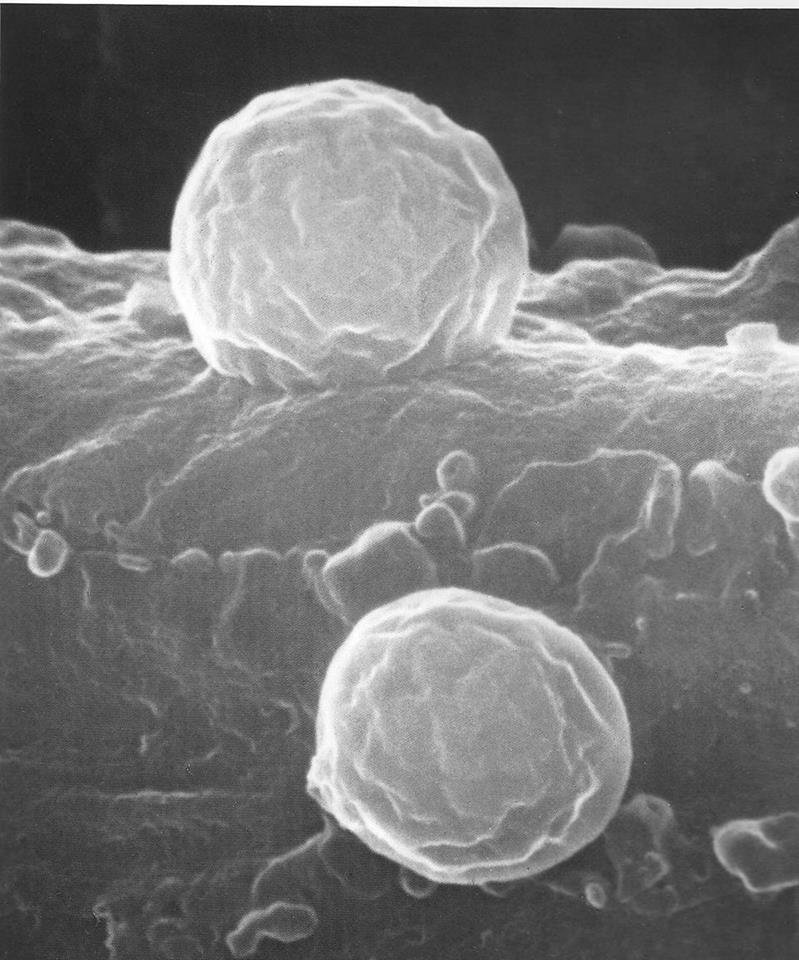
tossine citotossiche, come quelle della Listeria monocytogenes, hanno la capacità di aggredire globuli bianchi, come i fagociti macrofagi.
nefrotossiche: (fonte) lo Stafilococco aureus può provocare infezioni in tutto l’organismo con la sua batteriemia, soprattutto cute, endocardite, polmonite necrotizzante potenzialmente letale e sindrome da shock tossico con la classica insufficienza renale acuta. Si stima che le sole infezioni da MRSA invasive causino circa 19.000 decessi/anno negli USA, il che è simile al numero totale di decessi dovuti a AIDS, TBC ed epatiti virali combinati (fonte);
(mio)-cardiotossiche: soprattutto da Streptococco pyogenes;
epatotossiche, gruppo citotossiche: soprattutto da Stafilocco aureus, con i suoi superantigeni tossici pirogeni e le emolisine;
ciliostatiche: agiscono sugli epiteli con cilia (ciglie) come quelli delle mucose tracheo-bronchiolari, inibendone il movimento, favorendo così la colonizzazione dei germi, come avviene con la tossina della Bordetella pertussis della pertosse.
Tossine come SUPERANTIGENI: molecole proteiche prodotte da batteri e virus come meccanismo di difesa contro il sistema immunitario dell’ospite, capaci di attivare un’abnorme produzione di linfociti T., la loro superstimolazione di numerosi cloni con massiccia stimolazione infiammatoria per una formidabile ed intensa produzione di citochine con rischio di shock e MOF (Multi-Organ Failure) cioè insufficienza funzionale multi-organo altamente letale; ed ancora febbre, ipercatabolismo proteico, shock emodinamico con scompenso del sistema immunitario e spesso morte del Paziente: è la sindrome da shock tossico nonché della intossicazione alimentare. Le tossine superantigeni vengono prodotte da un numero crescente di batteri, tra i quali lo Staphylococcus aureus e specie di Streptococcus con conseguenze cliniche pesantissime.
ANATOSSINE: esotossine che hanno perso la proprietà di comportarsi come sostanze nocive, conservando invece quella di antigene; da qui la potenzialità di stimolare la reazione anticorpale dell’ospite, utile nei programmi di vaccinazione, laddove possibile.
ENDOTOSSINE: si trovano sulla parete cellulare dei batteri G.-, già viste prima parlando della loro membrana batterica esterna, molecole resistenti agli agenti chimici e fisici, termostabili all’autoclave (15’ a 121 °C) che si riassumono nel già nominato lipopolisaccaride (LPS), liberato alla morte del batterio in modesta concentrazione dai germi in crescita o da quelli lisati a causa di efficaci meccanismi di difesa dell’ospite o dalle attività di alcuni antibiotici ed in quantità pericolose ed anche letali se non dominati.
La loro resistenza ai vari agenti fà sì che le si possano trovare negli alimenti, farmaci, materiale organico (allevamenti, macellazione, trattamento di acque reflue e di rifiuti organici ecc.) come frequenti microinquinanti ambientali ed atmosferici per ingestione, ma soprattutto per inalazione, intuitivamente in molti posti di lavoro e nelle abitazioni con scarsa igiene.
Le endotossine risultano più pericolose delle esotossine.
Il LPS, in piccole quantità attiva i monociti che -> macrofagi e molti mediatori dell’infiammazione; il LPS assorbito quotidianamente in modeste quantità stimola positivamente il sistema immunitario (fonte) essendo i batteri G.- parte della flora microbica intestinale normale e quindi piccole quantità di LPS sono sempre assorbite, ma in quantità elevate questa endotossina, per la quale gli anticorpi non hanno effetto sul potere tossico, generano o possono favorire effetti comuni come: febbre (pirogenicità), attivazione del complemento (vedi avanti) e della trombosi (coagulazione patologica, vedi avanti), batteriemia e la colonizzazione dei tessuti profondi, cioè dei visceri.
Pirogenicità: è la capacità di indurre febbre da parte dei macrofagi (ricordo che sono monociti attivati) che liberano mediatori cellulari, fra i quali TNFα (Tumor Necrosis Factor alfa), IL1 (InterLeuchina 1), IFN (Interferone), tutte citochine a potente azione infiammatoria (problematiche già viste prima, in “superantigeni”) con molte ripercussioni che raggiungono l’ipotalamo stimolato a produrre prostaglandine (vedi avanti) e quindi febbre, alterando in eccesso la temperatura ritenuta “normale”. Il danno ulteriore di queste citochine (vedi a fine endotossine) pro-infiammatorie è qui elencato.
Attivazione del Complemento. Il sistema del complemento è costituito (fonte) da una dozzina di proteine circolanti, per lo più prodotte dal fegato e dai loro recettori di membrana, capaci di interagire sia tra di loro che con le membrane cellulari: è questo un compito fondamentale dell’immunità innata (vedi prima a “superantigeni”), naturale e di quella acquisita, per l’innesco della risposta protettiva in rapporto ai batteri patogeni. Se l’intensa formazione dei predetti pori sovrasta le possibilità di riparazione cellulare, il liquido extra-cellulare penetra per gradiente osmotico e fà “scoppiare” la cellula con rilascio del contenuto intracellulare nell’interstizio connettivale e
quindi flogosi. Accanto al complemento, la funzione delle
opsonine, macromolecole favorite dalla attivazione del complemento con la formazione preferenziale delle IgG. Esse rendono riconoscibili gli immunocomplessi, sinonimo complesso antigene-anticorpo, da parte dei recettori dei macrofagi per un componente dell’Ab (Ig) stesso: ciò favorisce (fonte) la captazione del germe con esaltazione della loro capacità fagocitaria. Da qui l’eliminazione finale dell’Ag (antigene). Gli immunocomplessi quando precipitano nei tessuti e soprattutto sull’endotelio o nella parete vasale, provocano reazioni infiammatorie dannose, classiche le artralgie da sindrome influenzale, ma anche dannosissime, come vasculiti, glomerulonefriti e la sclerodermia.
Infiammazione, immunità e complemento sono legati anche da un punto di vista genetico-evoluzionistico, come si evince dalla organizzazione dei geni sul cromosoma 6.
Attivazione della trombosi o coagulazione patologica con possibilità di trombi negli ambiti più disparati con la severa e talora fatale CID (Coagulazione Intravascolare Disseminata). Al modulo 3, lezione n. 11 vi ricordo l’Amico R. Virchov con la sua preziosa triade della trombofilia. Ricordo la microtrombosi dei capillari alveolari polmonari in corso di Covid-19 con compromissione dell’ematosi.
Vasodilatazione periferica per > della permeabilità dei capillari e pertanto edema, soprattutto polmonare, miocardico, renale e cerebrale. Da qui
stasi ematica con ipossia stagnante (venosa), ipotensione, fino allo shock emodinamico.
Aumento del metabolismo proteico sproporzionato con effetti catabolizzanti (consumo estremo di proteine o massa magra, come fonte di ATP, energia) , acidosi metabolica (vedi in fondo) ed iperstimolazione come superantigeni dei linfociti T descritta prima nelle esotossine, ma inefficace, anzi deleteria. Ricordo che il compito dei Linfociti T, compromessi soprattutto in caso di HIV, è quello di attivarsi in caso di infezioni virali, micotiche e da TBC.
Alcune definizioni come prima promesso.
CITOCHINE: sono piccole proteine talora con carattere di ormone, prodotte da varie cellule ed immesse nell’interstizio (fonte) che si legano a specifici recettori di membrana cellulare alla quale comunicano stimoli alla mitosi, a differenziarsi o a morire (apoptosi). La loro kínēsis si attua muovendosi verso i siti di infiammazione, infezione e trauma. Se ne osservano 4 gruppi:
le emopoietine, includono fattori di crescita come l’eritropoietina (Epo, ormone renale che stimola il midollo rosso, osseo, a produrre globuli rossi come ricambio fisiologico, in corso di anemie e di ipossie ipossiche) e diverse interleuchine prodotte dai Leucociti;
le chemochine anch’esse prodotte dai leucociti, con le interleuchine svolgono un ruolo fondamentale nella regolazione e nell’attivazione dei meccanismi di difesa (fagocitosi e produzione di anticorpi) e nei processi infiammatori;
il fattore di necrosi tumorale (TNFα): ne ho parlato oltre 10 anni fa in un articolo dedicato nella “obesità”, ma torna utile far riflessione adesso in campo infettivologico dove lo troviamo attivo nelle infiammazioni sistemiche acute, prodotte per lo più dai macrofagi (monociti attivati), ma anche in modesta concentrazione, anche dal resto dei globuli bianchi e dai mastociti;
gli interferoni (IFN): sono glicoproteine solubili che inducono le cellule a resistere agli attacchi virali soprattutto con i linfociti T, favoriscono l’inibizione della crescita cellulare (effetto antimitogeno) anche in campo Oncologico, hanno effetti immunosoppressori, di potenziamento dei macrofagi, dei linfociti natural killer (NK, macrofagi di derivazione dai linfociti B), ancora della fagocitosi dei granulociti neutrofili ed infine attività che promuovono la differenziazione cellulare e quindi della funzione specifica. L’IFN è anche coinvolto nella patogenesi di varie malattie: del collagene come il Lupus eritematoso sistemico (LES) e l’artrite reumatoide, del diabete mellito I.D., dell’epatite fulminante e della pancreatite necrotico-emorragica, della nefrite, della sclerosi multipla (SM), delle malattie allergiche e dell’aterosclerosi. Allo stato attuale, l’IFN è clinicamente utilizzato nella terapia delle infezioni da HBV ed HCV, nel carcinoma renale, glioblastoma, linfoma maligno e leucemia mieloide cronica, melanoma maligno, mieloma multiplo (tumore delle plasmacellule di derivazione dai linfociti B), tumori della cute.
Tre tipi di IFN:
interferoni (IFN) alfa: il preciso funzionamento dell’interferone alfa non è ancora chiaro, ma ci sono evidenze che possa aiutare il sistema immunitario attivando i linfociti nella lotta contro i virus e contro le cellule tumorali, indotte a diminuire la mitosi.
IFN beta: anche qui incertezze sui reali comportamenti della molecola, ma sembra utile nella strategia terapeutica delle forme acute e recidivanti di sclerosi multipla, per ridurne il numero delle recidive e per ritardare l’aggravarsi clinico dei Pazienti. Sembra provenire dai fibroblasti e dalle cellule epiteliali sotto stimolo virale.
IFN gamma: prodotto dai linfociti T attivati e linfociti NK in risposta ad alcune interleuchine. Presenta attività immuno-modulante ed ha bassa attività antivirale.
Acido arachidonico: parto da quest’acido per parlare di altro, essendo un componente fondamentale dei fosfolipidi della membrana cellulare e ad espressione biochimica estremamente versatile. Da questo acido, (fonte) in risposta ad agenti ormonali ed a stimoli chimici o fisici si formano prostaglandine, acidi grassi insaturi, leucotrieni, importanti mediatori del processo infiammatorio ed endoperossidi che a loro volta formano prostaglandine, prostacicline (di derivazione dalle prostaglandine), reperibili soprattutto sulla parete endoteliale dei vasi, hanno effetti opposti a quelli dei trombossani, di natura lipidica, inibendo l’aggregazione piastrinica e determinando vasodilatazione.
Endoperossido: è una prostaglandina-enzima che catalizza la conversione di acido arachidonico in endoperossido prostaglandinico e quindi nelle successive molecole, quasi ad effetto domino.
Acidosi metabolica: qui parliamo di equilibrio acido-base che richiede un prelievo di sangue arterioso denominato EGA (EmoGasAnalisi), dall’arteria radiale al polso, o come spesso facevamo noi in Chirurgia, dall’arteria femorale all’inguine.
5 i referti all’EGA: normalità, acidosi metabolica, acidosi respiratoria, alcalosi metabolia ed infine alcalosi respiratoria. Discorso estremamente complesso che cercherò di farmi esporre da un’Amica/Amico Anestesista-Rianimatore. Per ora vi dico soltanto che l’acidosi metabolica con pH < 7.10, è un problema sindromico (ricordo: un insieme di segni e sintomi) con la primaria < del bicarbonato (HCO3−) quindi < della pCO2 (iperpnea compensatoria per eliminare CO2 a valenza acida) dove i rapporti degli elettroliti + come il Na+ e quelli -, come il Cl- e l’HCO3-, sono sbilanciati a favore degli ioni +. Ciò si osserva essenzialmente: nella chetoacidosi nel diabete mellito di tipo 1 e 2, mal/denutrizione con mancato accesso alla alimentazione in primo piano (Paesi poveri) e quindi alcolismo cronico, dieta prolungata prettamente proteica (le diete Plank e Dukan dall’alito acetonemico insopportabile che non apprezzo, ma vi dico il perchè, peraltro intuitivo), digiuno prolungato, > dell’acido lattico (C3H6O3) che ricordo, nelle ipossie ischemiche (lezione n. 11, modulo n. 3) da IMA o emorragie severe, richiede un metabolismo anaerobico con produzione dal glucosio di 2 molecole di acido lattico e basso ATP, invece di H2O, CO2 e molto ATP, nello shock di vario tipo (l’IMA e le emorragie predette sono ovvie), nella severa insufficienza renale per < escrezione (III° funzione del nefrone) di acidi e di riassorbimento di ioni bicarbonato (HCO3-), nei politraumi con lesioni complesse dell’apparato muscolare, nell’assunzione volontaria o accidentale di acidi, nella diarrea protratta, tipo colera, dissenteria bacillare o nella drammatica abitudine degli anoressici di assumere catartici (lassativi) in grandi quantità ripetute con perdita di acqua, bicarbonati e SALUTE!!!
ANTIBIOTICI, cenni.
Prima di parlare degli antibiotici, ricordo due definizioni che fanno peraltro parte del quotidiano del personale sanitario:
antisettici, prodotti della biochimica utilizzati per sterilizzare le superfici dei tessuti viventi quando il rischio di infezione è elevato, come prima e durante un intervento chirurgico o invasivo, nelle piaghe, ulcere e ferite; e
disinfettanti, antimicrobici non selettivi che uccidono una vasta gamma di microrganismi, compresi i batteri. Sono utilizzati su superfici non viventi, ad esempio negli Ospedali. Oltre ai batteri ovviamente, ci sono anche miceti e virus che possono rappresentare un pericolo per l’uomo per i quali sono previsti rispettivamente farmaci antifungini e antivirali.
Solo le sostanze che colpiscono i BB sono chiamate antibiotici, la maggior parte dei quali sono prodotti
in laboratorio, ma già rilevati in natura; alcuni sono altamente specializzati, efficaci solo contro alcuni batteri, altri noti come antibiotici ad ampio spettro, attaccano una vasta gamma di batteri, compresi quelli che ci sono utili (link).
Essi, già detto, non hanno azione sui virus (la prossima lezione n. 44) link in preparazione.
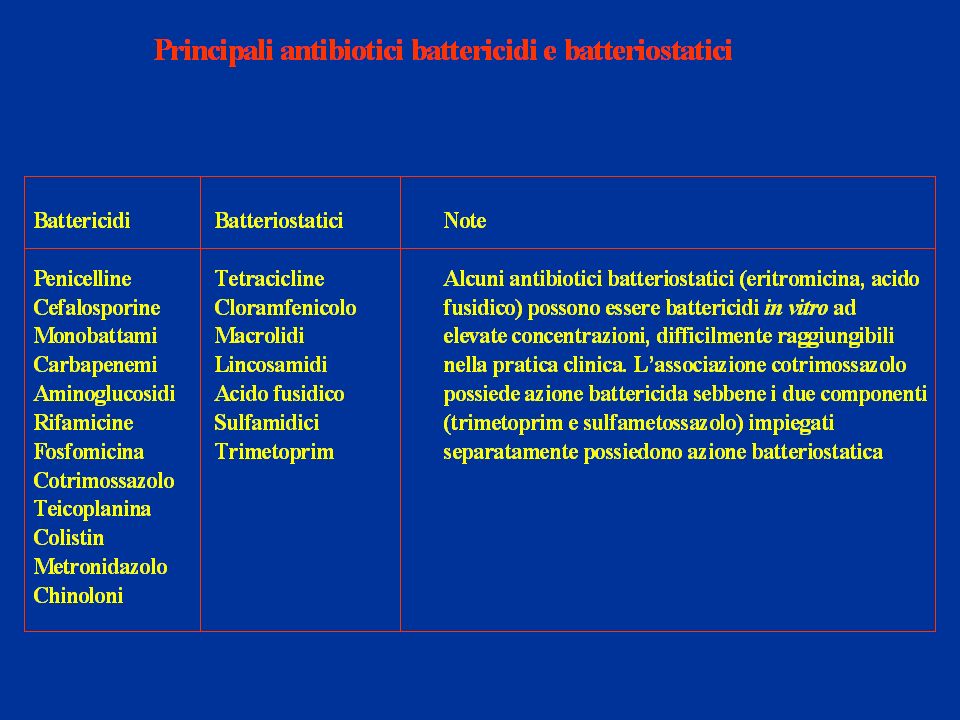
Gli antibiotici vengono definiti in due gruppi, a seconda della modalità di effetto sui batteri:
battericidi, cioè uccidono i BB bloccando il meccanismo responsabile della costruzione delle loro pareti cellulari, come con la Penicillina e le Cefalosporine, oppure impedendo crescita, espansione e divisione della parete per la mitosi, “indurendola”, come avviene per i nuovi glicopeptidi come la corbomicina e la complestatina (fonte del 12.02.2020), preziose nella terapia dell’MRSA (Staphylococcus aureus resistente ai farmaci-Meticillina);
batteriostatici quando sono in grado di contrastare la riproduzione dei batteri impedendo ai nutrienti di raggiungerli, con loro impossibilità di crescere, riprodursi e quindi di “vivere”; ciò avviene con la Tetraciclina e l’Eritromicina.
Fermando o ritardando l’infezione, si dà tempo al sistema immunitario, che ricordo essere fagocitosi e produzione di anticorpi, di organizzarsi e quindi di reagire.
Per il Coronavirus link dedicato.
Modulo n. 20, lezione n. 44:
Virus: cosa sono e loro caratteristiche biologiche.
Quando si parla di virus, così come con i batteri e dopo vedremo con i miceti, tutto si basa su 2 elementi caratteristici:
patogenicità e virulenza del virus, e
risposta dell’ospite prescelto, prima inconsapevole e poi aiutato e difeso dai nostri poteri immunitari che ricordo essere fagocitosi e produzione di anticorpi.
Per inciso, introduco il concetto di malattia autoimmune: non di rado la risposta immunitaria può “sparare”, colpire con gli anticorpi o aggredire con la fagocitosi non solo il virus, ma anche elementi cellulari o funzioni biologiche dell’ospite. Vediamola a grandi linee, chiarendo subito il concetto:
un agente patogeno biologico, virus qui (come batteri, miceti, protozoi ecc.) è capace, a seconda della propria virulenza, che vuol significare la quantificazione del danno biologico più o meno severo procurato, vincendo le nostre armi di difesa e modificando di continuo, da un ospite all’altro, il proprio corredo genomico per nascondersi e proteggersi.
Come ho fatto con la lezione sui batteri anche qui sui virus mi sembra didatticamente utile ripercorrere lo stesso schema espositivo, come spero di fare anche per i miceti, più in là. Cioè:
Introduzione
Ambiente
Dimensioni
Struttura e forme
Tropismo
Produzione di energia e nutrizione
Modalità di ingresso nell’Uomo
Replicazione virale
Virulenza
Classificazione
Virus e cancro
Oncosoppressori
Terapia antivirale con il link del Ministero della Salute, del febbraio 2018.
INTRODUZIONE: sono i più piccoli microbi acellulari (o subcellulari quindi non procarioti), mobili, parassiti intracellulari obbligati poiché necessitano di organismi, dagli unicellulari come batteri e protozoi ai funghi, alle piante ed a quelli animali ed umani per essere ospitati (infezione) e moltiplicarsi (virus “figli”); sono altresì sprovvisti di enzimi metabolici, ben diversi dai germi ubiquitari. Con il termine prima nominato “ospite” si descrive in realtà la serie di cellule che un virus può infettare. Il termine più appropriato sarebbe “vittima” o addirittura “ospite violentato”. I virus possono essere visti come elementi genetici mobili, molto probabilmente di origine cellulare, ma ancora non defnita e caratterizzati da una lunga coevoluzione di virus ed ospite (fonte)
nel quale, con l’infezione avviene l’”espressione” del genoma che significa trascrizione e traduzione.
AMBIENTE: pertanto biologico obbligato, detto nell’INTRODUZIONE.
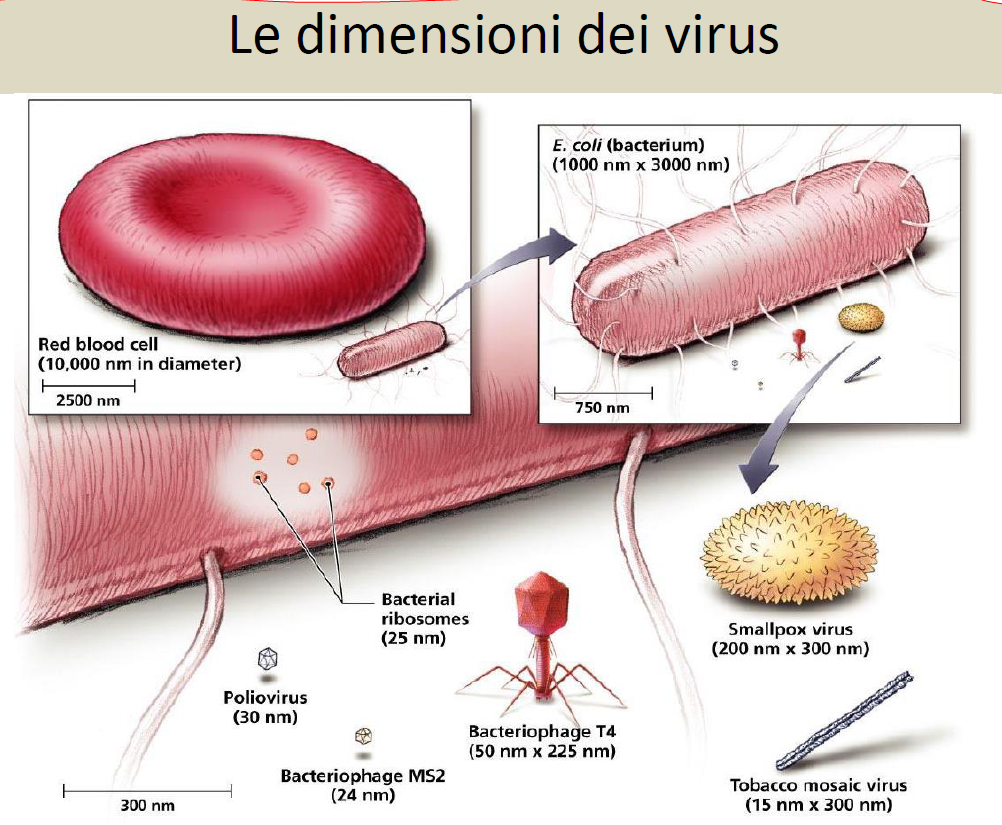
DIMENSIONI: con i virus parliamo di nanometri, nm, cioè di 1 miliardesimo di metro (simbolo nm), 1 milionesimo di mm.. e pertanto visibili solo al microscopio elettronico.
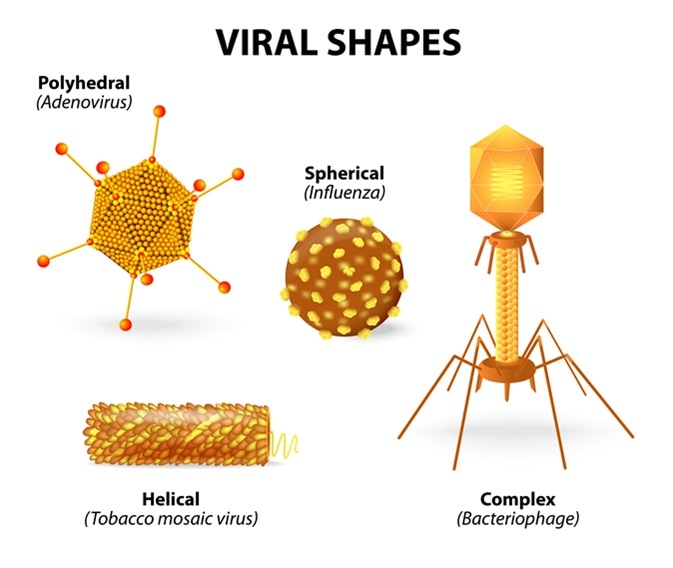
STRUTTURA e FORME: sono composti da un filamento unico o doppio, lineare o ad elica circolare di

acido nucleico di DNA o desossiribovirus (la doppia elica circolare la troviamo anche nei plasmidi dei batteri), rappresentano il 30% dei virus, mentre quelli a RNA o ribovirus il 70% restante, acidi che trasportano ovviamente i dati ereditari, una sorta di “core” o pseudonucleo circondato, “impacchettato” in una struttura di rivestimento di proteine simmetriche detto càpside (dal Lat. capsa, involucro) i cui elementi proteici, uno o più, sono detti capsomeri. Tale capside si assembla in millisecondi (!) ed oltre ad “impacchettare” il genoma, stabilizza il virus, ne determina la

forma e lo protegge dall’ambiente esterno. I genomi di alcuni virus sanno produrre gli enzimi finalizzati all’ingresso nella cellula “vittima” dell’infezione, ma non enzimi capaci di metabolismo all’interno dell’ospite (già detto prima).
Ora due specificazioni doverose.
DNA: acido desossiribonucleico a doppio filamento ad elica, contenente tutte le informazioni genetiche necessarie per la sintesi dell’RNA e delle proteine specifiche del metabolismo cellulare specifico.
RNA: acido ribonucleico, polimero a singolo filamento di nucleotidi, implicato in molteplici compiti di codifica, decodifica, regolazione ed espressione dei geni.
Riprendiamo il discorso: acido nucleico + capside formano il virione, la particella virale base.
Questa struttura virale centrale, ovvero il nucleocapside, è talvolta circondata da una membrana chiamata pericapside (fonte) di natura lipoproteica (nella foto indicato come rivestimento lipoproteico), che deriva da elementi biochimici di precedenti “ospiti” (significato che vedremo più avanti) con fosfolipidi e due glicoproteine di membrana, emoagglutinina e neuraminidasi sporgenti, intelligenti (!), detti peplomeri, con funzioni enzimatiche e proprietà antigeniche e recettoriali, caratteristiche che li rendono in grado di identificare cellule idonee per il loro “insediamento” verso le quali si “spostano” attraverso il riconoscimento dei recettori idonei delle loro membrane cellulari “sensibili” e quindi di penetrarli. Classici i peplomeri “a corona” del Coronavirus e dei Retrovirus dell’HIV. Il pericapside ancora, ha rilevanza antigenica, da spiegare più avanti. Per inciso riferisco che le fibre della coda di alcuni batteriofagi, rappresentano peplomeri
modificati
Ho detto prima “nucleotide talvolta circondato”, perché l’assenza di pericapside conferisce al virus l’aggettivo “nudo”, quelli con, il termine di “virus rivestiti” per il suddetto pericapside.
La tipologia di organizzazione molecolare del nucleocapside conferisce al virus due tipi di struttura, elicoidale e icosaedrica, qui poliedro regolare, con 20 facce a triangolo equilatero. Nella prima, i capsomeri sono disposti elicoidalmente attorno al genoma virale, dando al virus una struttura simile a un tubo, asta o filamento. Nel secondo caso, la simmetria icosaedrica conferisce al virus una forma sferica, tipo pallone da football.
Nei batteriofagi, visti nell’articolo sui batteri (link) e poi qui, più avanti, si osserva un doppio filamento di DNA con combinazione di forme di aste e sfere e nel virus del vaiolo, Poxvirus variolae, si ha un’architettura compatta “a mattone” particolare e talora con code che li configurano come virus complessi per la struttura.
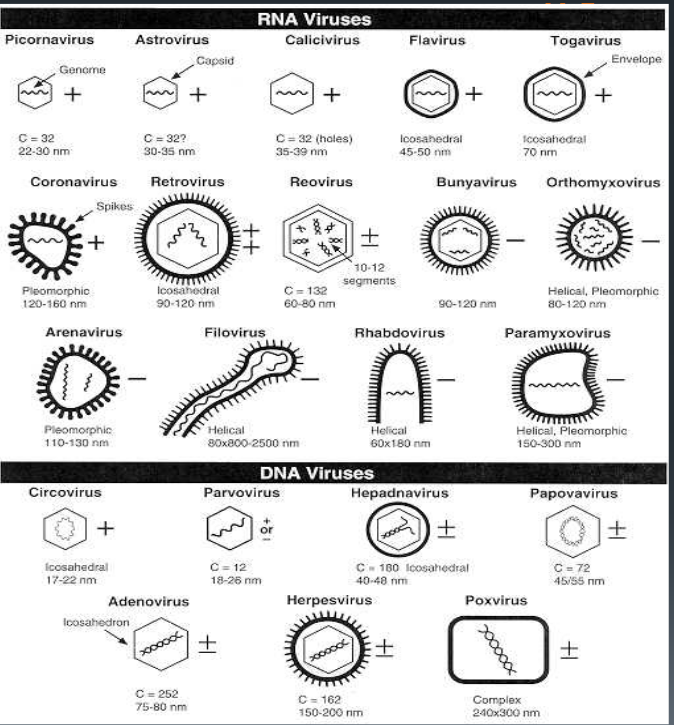
TROPISMO: è il concetto dell’analisi e della scelta che opera il virus per allocarsi dove meglio possibile, scegliendo l’indirizzo da ciò che è scritto sulla porta (riconoscimento di un recettore specifico di superficie) per poi entrare prepotentemente senza chiedere permesso in quella casa, vagliando la mercanzia che contiene (fattori intracellulari richiesti), ritenendola idonea alle proprie necessità e la sceglie come cellula bersaglio idonea, una casa sicura che scoppierà sia per il danno strutturale con morte della cellula (infezione virale) e quindi perdita di quella funzione, sia per il numero enorme di virus replicati incontenibili.
PRODUZIONE di ENERGIA e NUTRIZIONE: diversamente dai batteri abbiamo capito che il virus, sprovvisto di armi biochimiche per il proprio sostentamento, “parassita” la cellula ospite (batterica, vegetale o animale come ormai sappiamo) per sfruttarne le risorse a proprio vantaggio per ”vivere”, cioè replicarsi, avendo strumenti biologici per indurre produzione di energia e farsi nutrire.
L’obiettivo finale quindi è: produrre molecole di RNA messaggero per creare proteine

virali, grazie alla traduzione indotta dalla cellula ospite.
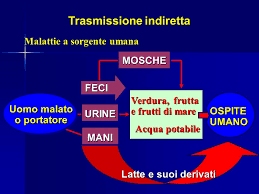
MODALITA’ di INGRESSO nell’UOMO. Il virus entra nella cellula umana attraverso la trasmissione orizzontale maggiormente, e verticale. La prima prevede una trasmissione diretta del contatto, fisico, persona-persona (rapporti sessuali, scambio di saliva ecc.) e persone-animali (punture di insetti, morsi di animali ma anche umani, saliva). La trasmissione indiretta avviene con “veicoli”, cioè “cose” e oggetti contaminati quindi persona-oggetto (maniglie, rubinetti, cellulari, tastiere, utensili, apparecchi ecc.), contaminazione fecale di acqua ed alimenti, inosservanza dell’igiene delle mani ecc..
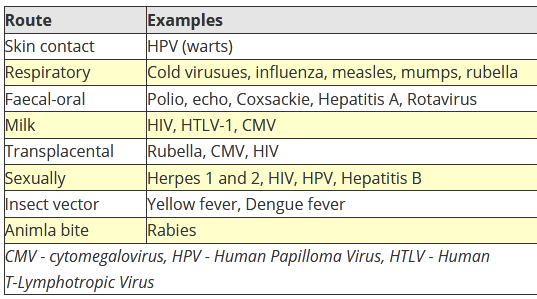
Utile questo schema che vi propongo. Per l’ingresso dalla cute ricordo graffi e ferite, manovre incongrue di frizione di asciugamani su cute dell’Anziano, morsi, punture di insetti, o inoculazione con aghi. Qui manca l’ingresso trans-congiuntivale, tanto vissuto con il Covid-19 e quello parenterale con trasfusioni di sangue e prodotti derivati, trapianti d’organo, soprattutto midollo osseo e rene, aghi, siringhe, port-a-cath, accessi endovenosi periferici e centrali. Ovvio il settore particolare dei soggetti a rischio come Operatori sanitari, politrasfusi, tossicodipendenti, collegiali ecc..
La trasmissione per via aerea si riferisce all’infezione respiratoria per inalazione del virus (epoca di Coronavirus, scrivendo a fine marzo 2020). Idem per la trasmissione per via digestiva con la deglutizione con le caratteristiche modalità dette e ridette: le 7 “f” inglesi (link -> poliomielite). Per tale
via ricordo le virosi più significative con il vaiolo, la polio, HAV, HEV, Adenovirus, Rotavirus e gastroenteriti.
La trasmissione verticale dell’infezione virale è quella determinata da un genitore alla discendenza, tipo madre-feto, madre-figlio (con il latte) e può essere pertanto ereditaria e congenita. La trasmissione ereditaria dipende dal genoma di un genitore, se il virus, come talora si osserva con i retrovirus, è in grado di includersi, integrarsi con il suo genoma con possibilità di trasmissione ereditaria. Le virosi a trasmissione congenita si definiscono così perché presenti alla nascita, non ereditarie, ovvio, ma acquisite in gravidanza per via trans-placentare, in ovo, in utero o durante il passaggio nel canale del parto; anche il latte può veicolare l’infezione, come avviene per l’HIV. Il virus

così può provocare un aborto se incompatibile con la vita, oppure determinare imperfezioni fisiche (deformità talora mostruose), infezione inapparente, non clinica.
REPLICAZIONE VIRALE: avviene usufruendo del meccanismo di replicazione della cellula ospite per replicare il proprio genoma, con meccanismi biologici complessi e differenti a seconda del genoma a RNA o DNA. “Assemblate” le molecole opportunamente, si formano i virioni che vengono rilasciati dalla cellula ospite, pronti per altre infezioni, o per sua lisi (cellula distrutta per “scoppio”) con formazione di virus nudi, o per germogliamento (per i virus avvolti, vestiti) dove i virioni passano all’esterno della cellula ospite uno alla volta.
Ecco così che la frase detta quasi all’inizio relativa al pericapside
“che deriva da elementi biochimici di precedenti “ospiti”
trova la sua spiegazione in quanto il virione che germoglia, modifica la membrana citoplasmatica dell’ospite inserendo e mescolando le proprie proteine con quelle della “preda”. Quando il capside protende verso l’esterno per l’uscita, “si veste” quindi del suo nuovo involucro di nuova doppia combinazione (membrana plasmatica modificata): ecco il pericapside. Sempre loro, i germoglianti, possono rimanere all’interno della cellula anche per anni, senza causare patologie: è questo il concetto di infezione latente o persistente abituale per l’RNA o il DNA degli Herpes virus, HIV e Papovavirus.
INFEZIONE CRONICA: le difese dell’organismo contrastano il virus, la malattia si riduce o scompare, ma il virus persiste nell’organismo, replicando a bassi livelli. Il paziente conduce una vita quasi normale anche per molti anni, finché gradatamente non si manifesta una grave malattia tipo HBV, HCV, HIV.
INFEZIONE LATENTE o PERSISTENTE: le difese dell’organismo impediscono al virus di replicare, la malattia scompare senza però l’eliminazione del virus dall’organismo. Il genoma-virione rimane, parcheggia in alcune cellule, “senza farsi replicare”, latente. In condizioni particolari e come spesso accade per calo delle difese da terapia immuno-soppressiva e stress psico-fisico, febbre, dai raggi UV del sole, ciclo mestruale, traumi locali ecc), il “nemico si sveglia” per replicare, diventando patogeno con una recidiva clinica. Come frequentemente e classicamente avviene con l’herpes simplex, dormiente in latenza nel ganglio di Gasser del n. trigemino, V° paio dei nn. cranici (-> nervi cranici, glossario, in fondo alla lezione n. 36 del modulo n. 14) ed in quello sacrale con recidiva clinica nel metamero corrispondente.
VIRULENZA: concetto già spiegato all’inizio della lezione, è pertanto la capacità, qui del virus, di “fare danno” all’organismo che li ospita provocando varie funzioni alterate, patologiche. Ma per “fare danno” bisogna entrare nell’ospite senza bussare, senza chiedere il permesso.
Ed ecco che vediamo la
CLASSIFICAZIONE dei virus per gruppi (tassonomica):
Ordine: virales, Famiglia (per la morfologia): viridae, Sottofamiglia: virinae, Genere: virus, Specie: virus.
Più di 30.000 virus sono oggi conosciuti e raggruppati in oltre 71 famiglie, 164 generi 3.600 specie.
Una famiglia di virus può essere costituita da membri che si replicano solo nei vertebrati, solo negli invertebrati, solo nelle piante o solo nei batteri; in alcuni casi ci sono virus che si replicano in più di uno di questi ospiti.
Qui piccole riflessioni solo su 20 famiglie e generi di importanza medica in ordine alfabetico. Cerchiamo di essere pratici, ricordando che i nomi delle famiglie terminano per “idae” nelle quali il virus rappresenta il genere.
1) Adenoviridae, da adeno, ghiandola, tessuto adenoide da cui i virus sono stati inizialmente isolati; virus con trasmissione attraverso l’aria, le mani, l’acqua con infezioni respiratorie lievi o con polmonite, cheratocongiuntivite, gastroenterite e cistite.
2) Astroviridae, da astron, stella; sono piccoli virus nudi stellariformi ad RNA; diarrea soprattutto nei bambini < a 5 aa..
3) Caliciviridae: per la loro forma, il virus infetta molti animali da cortile, da compagnia, delfini ed anfibi sia attraverso la via oro-fecale che respiratoria. Questa famiglia comprende il Norovirus, altamente contagioso e responsabile di infezioni gastrointestinali, comunemente definita influenza intestinale. I segni e sintomi più frequenti includono mal di stomaco improvviso, nausea, vomito e diarrea. Attenzione! Poiché il virus rimane presente nelle feci per molti giorni anche nei portatori asintomatici è causa pertanto di grandi episodi epidemici nei bambini, nelle comunità numerose e in chi non ha accesso ad un’igiene adeguata di mani e servizi igienici. C’è di più: questa virosi non determina un’immunità valida, pertanto le recidive sono frequenti. Qualche Virologo inserisce in questa famiglia l’HEV (vedi 7)
4) Coronaviridae il famigerato killer della polmonite interstiziale del 2020; corona, per l’aspetto dei peplomeri che sporgono dalla superficie virale, ma più che di “corona” si dovrebbe parlare di un “pesce palla” o di una pallina da ping pong con mini garofani rossi impiantati. Sono virus a RNA a monofilamento, dal diametro di 100-150 nm. rivestito da un capside a simmetria elicoidale e da un pericapside con le classiche formazioni glicoproteiche che io chiamo a “mazza di tamburo” o a “garofano” che danno il tipico aspetto. Iin realtà questi virus, insieme ai rinovirus (vedi avanti), sono i maggiori responsabili del comune raffreddore ma anche di drammi epidemici come la sindrome respiratoria del Medio Oriente, la MERS (Middle-East Respiratory Syndrome), grave nelle persone anziane e in quelle con comorbilità, come anche per il Covid-19, letale (fonte) in circa 1/3 delle decine di migliaia di persone infettate negli anni dal settembre 2012 fino ad oggi, infezione ancora attiva (!), con
un tasso di mortalità pari a circa il 34%, e la sindrome acuta severa respiratoria, la SARS (Severe Acute Respiratory Syndrome), infezione, questa, invece debellata; il tasso di letalità fu del 10%.
Il coronavirus attuale non è uguale a quelli precedenti. La comparsa di nuovi virus patogeni per l’uomo, (fonte) precedentemente circolanti solo nel mondo animale, è un fenomeno ampiamente conosciuto (chiamato spill over o salto di specie) e si pensa che possa essere alla base anche dell’origine del nuovo coronavirus (SARS-CoV-2). Al momento (sto scrivendo il 29 marzo 2020) la comunità scientifica sta cercando di identificare la fonte dell’infezione.
5) Filoviridae, filamentosi, comprende due micidiali virus ad elevata mortalità, quello della febbre emorragica di Marburg ed il più noto Ebolavirus (Ebola, nord del Congo e non in Sudan) capace di provocare nei mammiferi, Uomo compreso, febbri emorragiche per patologie della coagulazione con sanguinamento spesso fatali. L’ebolavirus fino al 2013 è stato responsabile di una dozzina di focolai nella Repubblica Democratica del Congo… se ti interessa, vai a VIRUS.
6) Flaviviridae: sono ribovirus, ossia a genoma ad RNA che comprendono il virus dell’HCV (epatite C), il virus amarillico della febbre gialla e quelli responsabili
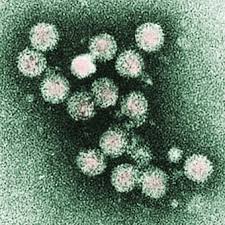
soprattutto della dengue, della encefalite da zecche e della malattia di West Nile. Utile link per queste virosi nel Nord Italia, molto didattico. HCV: l’epatite C è una malattia del fegato contagiosa, dovuta all’infezione del fegato da parte del virus a RNA a singola catena dell’epatite C e si trasmette soltanto attraverso il sangue delle persone infette quindi NON con gli altri fluidi corporei come avviene per l’HBV e l’HIV, ed ancora: in questi ultimi due virus si documenta una presenza latente intra-epatocitaria, detta “internalizzazione” in assenza anche di replicazione, fenomeno invece classicamente attivo e vivace per l’HCV con le severe conseguenze a distanza suddette. Quadri clinici molto variabili, da lievi a gravi, con tassi di cronicizzazione del 70-80% che portano 1/5 di questi pazienti a sviluppare dopo molti anni una cirrosi epatica. Ogni anno (fonte) 3-4 milioni di persone si infettano con l’HCV e 150 milioni di persone ne sono cronicamente infette e sono quindi a rischio di sviluppare cirrosi e/o epatocarcinoma.
L’infezione cronica da HCV è la principale causa di morte per malattia epatica ed è l’indicazione più comune al trapianto di fegato. La produzione anticorpale del Paziente, è sempre modesta ed insufficiente per una reale difesa attuale: da qui la mancanza di un vacino idoneo.
7) Hepadnaviridae con il B Virus o HBV: famiglia di virus a DNA con spiccata aggressione all’epatocita provocando la deleteria epatite B (fonte Istituto Superiore di Sanità), con trasmissione attraverso sangue, liquido seminale e secrezioni vaginali. Da qui i rapporti sessuali non protetti, ma molti “giochi” si attuano senza profilattico (!), promiscuità in rasoi, spazzolini da denti e siringhe, qui spesso in modo assurdamente rituale. L’epatite può essere trasmessa dalla madre al figlio durante il parto. Esiste il vaccino e per noi Operatori sanitari è obbligatorio.
8) Herpesviridae, sono virus a DNA. Degli oltre 100 tipi noti, 8 di essi infettano abitualmente solo gli esseri umani e tutti possono creare un’infezione latente all’interno di tessuti specifici, caratteristici per ogni virus (fonte):
a) herpes simplex di tipo 1 e 2: la trasmissione dell’Herpes S. 1 (HSV-1) è principalmente orale, labiale, quella del tipo 2 (HSV-2) è principalmente genitale da contatto intimo. Le manifestazioni
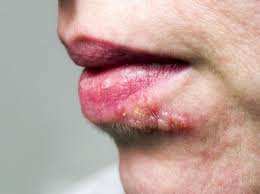
cliniche: gengivo-stomatite, herpes genitale, cheratite erpetica, patereccio (giradito) erpetico, infezione neonatale, encefalite.
Il virus si replica inizialmente nelle cellule epiteliali, producendo una vescicola su base eritematosa, quindi risale lungo i nervi sensoriali nei gangli della radice dorsale (ricordo: radice dorsale del midollo spinale per le afferenze sensoriali e quella anteriore per le efferenze motorie), dove si replica latente (nascosto). Quando si riattiva, il virus si diffonde dal ganglio verso la periferia, lungo le fibre assonali (bianche!) per riprendere recidive cliniche cutanee e/o mucose. L’interferone e l’immunità umorale sono importanti difese, ovviamente deficitarie nei soggetti immunodepressi;
b) varicella-zoster: virus altamente contagioso; circa il 95% degli adulti presenta evidenza sierologica di infezione; quella primaria è responsabile della varicella mentre la riattivazione del virus latente negli adulti provoca l’herpes zoster (fuoco di Sant’Antonio), che si manifesta con eruzione cutanea vescicolare lungo la distribuzione del nervo, a dermatomero, cioè della regione innervata da una singola radice spinale posteriore. A ciò si accompagna la neurite acuta dolorosa, alla quale può talora reliquare la terribilmente dolorosa e mal dominabile nevralgia post-erpetica. Le vescicole sono ripiene di virus attivi e quando si rompono per grattamento o per gesti inappropriati di “svuotamento”, il virus effettua la sua ulteriore azione infettiva. Anche qui interferone ed immunità cellulare e umorale sono importanti difese mentre nei pazienti immunodepressi la ripresa della attività del virus può causare malattie diffuse severe quali vasculopatie, mielopatie, necrosi retinica ed infezione cerebellare;
c) citomegalovirus: le loro infezioni sono tra le più diffuse in tutto il mondo; sono responsabili di tre sindromi cliniche:
1) forma congenita e se clinicamente sintomatica, provoca epatosplenomegalia, retinite, eruzione cutanea e turbe del SNC;
2) mononucleosi in circa il 10% dei bambini più grandi e degli adulti, con febbre, faringodinia (mal di gola), astenia e malessere con linfocitosi (> del n°. dei linfociti) atipica (anche modulo n. 3, lezione n. 10);
3) virosi sistemiche potenzialmente letali per interessamento di polmoni, tratto gastrointestinale, fegato, retina e SNC nei pazienti immunodepressi, come i soggetti sottoposti a trapianto e quelli con infezione da virus dell’immunodeficienza umana (HIV). Il virus si replica molto a rilento e principalmente nelle ghiandole salivari e nei reni, motivo per il quale si reperta nella saliva e nelle urine. La trasmissione avviene tramite contatto intimo con secrezioni infette;
d) virus di Epstein-Barr: provoca la classica mononucleosi come nelle espressioni del citomegalovirus. Negli ospiti immunodepressi il virus provoca una sindrome linfoproliferativa e si replica nelle cellule epiteliali dell’orofaringe e nei linfociti B, trasmettendosi per contatto intimo, in particolare con lo scambio di saliva. Esiste una correlazione tra questo virus e l’insorgenza di carcinoma gastrico prossimale (corpo e cardias) e naso-faringeo, sede vista prima elettiva di replicazione, con il m. di Hodgkin, sindromi linfoproliferative in pazienti immunodepressi ed il linfoma di Burkitt, tumore maligno altamente aggressivo e a rapida evoluzione del sistema linfatico a linfociti B … vai alla lezione se ti interessa;
e) herpesvirus umano 6 (varianti A e B) e 7: sono associati ad esantema maculo-papulare detto roseola dei bambini o pseudorosolia o VI° malattia con possibili convulsioni febbrili e linfoadenopatia cervico-auricolare posteriore. L’HHV-7 merita qualcosa di più. Oltre ad essere stato rilevato in dermopatie come psoriasi e pitiriasi rosea, il virus si può evidenziare in alcuni casi di morbo di Hodgkin (modulo n. 4, lezione n. 16) frequente nei maschi nelle comunità adolescenziali tipo College, con invasione dei monociti e nei pazienti sottoposti a trapianto renale. La capacità dell’HHV-7 di indurre la produzione di citochine nelle cellule infette potrebbe rendere l’HHV-7 un importante cofattore patogenetico nei disturbi infiammatori e neoplastici;
f) herpesvirus umano 8 si trova associato al sarcoma di Kaposi
sarcoma di Kaposi parietale sin. di Tom Hanks in Philadelphia, 1993nei pazienti con AIDS e tumori solidi (GIST-Gastro-Intestinal-Stromal-Tumors, sarcomi e linfomi intra-addominali).
9) HEV: virus talora inserito nella famiglia dei Caliciviridae, provoca un’epatite acuta con incidenza crescente negli ultimi lustri, per acqua e cibo contaminati dal virus che viene eliminato con le feci umane ed animali, sporadicamente da trasfusioni e trapianti. La maggior parte delle infezioni da HEV decorre in forma asintomatica;
10) Orthomyxoviridae: famiglia di virus a RNA. Si elencano 7 gruppi di virus, 4 virus infuenzali interessano l’Uomo direttamente o tramite animali e presentano un pericapside a simmetria elicoidale di protezione che consente loro di entrare e uscire agevolmente dalla cellula infettata. Ecco i 4 virus umani:
influenzavirus A, genera tutte le pandemie di influenza e infetta l’Uomo, mammiferi e uccelli (aviaria); influenzavirus B, infetta l’Uomo e pinnipedi; influenzavirus C Uomo e suini; influenzavirus D, Uomo, uccelli (forma aviaria), suini, bovini ed altri mammiferi.
La pandemia di influenza del 1918, indicata come influenza spagnola, è stata causata da un virus dell’influenza A H1N1 insolitamente grave e mortale. Circa 100 milioni le vittime, almeno il 5% della popolazione mondiale, maggiormente giovani adulti sani, al contrario dell’evenienza comune di maggiore mortalità negli anziani con comorbilità e quindi più fragili. Ancora un dato storico: virus A H3N2 responsabile della pandemia di influenza di Hong Kong del 1968-1969: uccise circa un milione di persone in tutto il mondo.
10) Papillomaviridae: sono piccoli virus ubiquitari (fonte) a DNA, resistenti al calore ed all’essicamento. Sono infezioni correlate all’attività sessuale per il numero dei partner ed alla frequenza dei rapporti oro-genito-anali, con rischio anche per le mani. L’età di massima insorgenza è tra i 15 e i 25 aa. I virus hanno un tropismo (per la definizione torna indietro, verso l’inizio della lezione) elettivo per le cellule dello strato basale e squamoso della cute (modulo 11, lezione n. 31) e per lo strato mucosale per lo più ano-genitale, orale (guance interne, lingua, orofaringe), penetrando nell’epitelio attraverso microabrasioni/traumi. Qui avviene l’infezione e lo stazionamento del virus, che può essere quiescente anche per molti mesi, replicandosi in quelle cellule “ospiti e vittime” dove può inserire il proprio genoma. Di solito il periodo di incubazione varia da 3 settimane a 8 mesi con frequenti infezioni associate all’HSV-2 ed alla Chlamydia trachomatis (batterio GRAM-, parassita intracellulare).
Descrivo ora le espressioni cliniche del virus che ha un comportamento assolutamente “stanziale”, loco-regionale, senza viremie.
La stragrande maggioranza delle lesioni sono benigne, come le verruche che interessano la cute di viso, mani e piedi o viso ed i condilomi acuminati o papillomi che interessano le mucose prima descritte, la maggior parte delle quali o regredisce spontaneamente grazie alle difese immunitarie o alla risposta alle terapie. Una minima parte invece delle situazioni non trattate perché asintomatiche o trascurate, può virare nel tempo verso una forma neoplastica, come avviene per il carcinoma squamoso della cervice (collo) dell’utero dove la presenza del DNA del virus è del 99,7% dei casi (fonte). L’HPV è ritenuto responsabile ancora (fonte del 2016) dell’88% dei tumori dell’ano, del 78% dei tumori della vagina, del 50% dei tumori del pene, del 25% dei tumori della vulva e di circa (fonte) il 26% dei tumori dell’orofaringe, tonsille e lingua nell’Europa sud-occidentale. Il virus HPV è in grado di indurre il processo di angiogenesi tumorale. Obbligatorio ricordare il PAP test e il PAP test dedicato alla ricerca dell’HPV con tecniche di biologia molecolare, e la vaccinazione ai giovani, maschi e femmine tenendo presente che è solo preventivo, quindi non somministrabile al Paziente con obiettività di malattia: il vostro Medico lo sa, ora lo so anche io (!), passandovi la dritta (fonte): il vaccino quadrivalente protegge dall’infezione dei tipi virali ad alto rischio 16 e 18, responsabili del 70% dei carcinomi della cervice uterina. Protegge inoltre dai tipi a basso
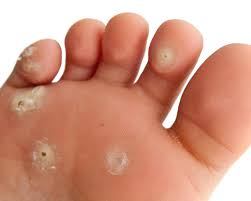
rischio 6 e 11, responsabili dei condilomi genitali. Il vaccino bivalente è diretto contro i tipi ad alto rischio 16 e 18. L’azione dei vaccini è comunque preventiva e non terapeutica, già detto prima.
12 gruppi di questi virus sono oncogèni (vedi dopo questa classificazione alfabetica).
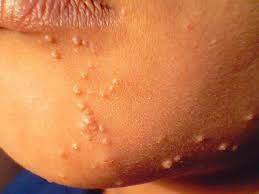
Ecco le due versatili manifestazioni dermatologiche: verruche e condilomi. Le verruche volgarmente porri, sono piccole escrescenze cutanee caratterizzate da notevole ispessimento dello strato corneo e da sfumature giallo-grigiastre che si manifestano soprattutto su mani, dita, viso, piante dei piedi, contorno ungueale e a livello genitale. Andare sul dal MMG che vi manderà dal Dermatologo! Condilomi, volgarmente detti creste di gallo, hanno

un aspetto fungoide o a cavolfiore, dalle dimensioni millimetriche e secondo l’ISS (Istituto Superiore di Sanità) la condilomatosi ano-genitale è la malattia contagiosa da trasmissione sessuale più frequente in Italia responsabile nel 90% dei casi il Papillomavirus umano (HPV) tipo 6 e 11. I giovani, in età post-adolescenziale sono i più interessati, omo- ed eterosessuali. Il periodo di incubazione è di circa 3 mesi con valide possibilità del sistema immunitario di portare a guarigione il Paziente. Ma… attenzione ai nuovi e ripetuti contagi con recidive cliniche superiori al 50%.
11) Papovaviridae acronimo di pa(pilloma), po(lioma), va(cuolante per la formazione di vescicole liquide intracellulari), è un termine piuttosto obsoleto, a favore di Polyomaviridae termine che si riferisce alla loro capacità di causare multipli (poly) tumori (-oma). Il loro acido nucleico può essere a DNA e a RNA. Il virione è piccolo e nudo. La famiglia comprende (fonte) 3 generi Orthopolyomavirus, Wukipolyomavirus e Avipolyomavirus: tutti di solito infettano i bambini con clinica nulla o molto povera, ma poi verosimilmente i virus si rendono latenti per tutta la vita. Il Paziente che si ammala invece è sovente immunodepresso come già più volte visto nell’anziano, nel trapiantato, nell’AIDS, nei malnutriti ecc. ammalandosi di leucoencefalopatia multifocale progressiva o PML (Progressive multifocal leukoencephalopathy) (ricordo ai miei Allievi, leuco, bianco, come la sostanza cerebrale ricca di assoni inguainati dalla mielina, isolante elettrico: nella sostanza bianca, sapete, i neuroni non “dialogano” tra loro, si conduce solo l’impulso elettrico) rara malattia degenerativa che attacca gli oligodendrociti (-> al link) del SNC da riattivazione del virus JC, dalle iniziali del primo paziente deceduto, malato anche di m. di Hodgkin, produttori appunto della mielina. Da qui la demielinizzazione con danni neurologici severi e morte precoce. Altre malattie: nefropatia da BK virus (del quale non si capisce l’acronimo) in pazienti trapiantati e pertanto sotto terapia immunosoppressiva, carcinoma di Merkel la cui infezione (Merkel virus) è diffusa nel 60-70% della popolazione adulta, ed altre veramente rare.
12) Paramyxoviridae, famiglia con genoma a RNA cui appartengono i patogeni parainfluenzali, il morbillo, la parotite ed altri meno frequenti dove la replicazione si esplica per gemmazione dalla membrana cellulare. I virus parainfluenzali provocano affezioni laringo-tracheali e bronchioliti nei neonati ed in tutte le età in caso di immunodepressione. Il virus della parotite infetta per via respiratoria di solito i bambini, replicandosi nel suo epitelio mucosale e nelle ghiandole linfatiche per poi, attraverso il sangue, localizzarsi soprattutto nelle ghiandole parotidee, ma anche, di rado, nel pancreas (pancreatiti para-influenzali con amilasi alte), testicoli (orchite parainfluenzale) e SNC. Il virus del morbillo (dal Lat. morbillus, piccolo morbo, malattia) è tipico dell’infanzia con un’esplosione di esantema generalizzato dovuto alla reazione tra cellule endoteliali vasali infettate e Linfociti T reattivi. Tale virus colpisce l’Uomo e le scimmie, si trasmette per via respiratoria, come il precedente della parotite. Può colpire anche il SNC con encefalite (-> encefalite) dai postumi talora drammatici, anche letali. Il virus respiratorio sinciziale (RSV) è da considerarsi il più pericoloso agente causale di infezione respiratoria nei bambini più giovani.
13) Parvoviridae, parvovirus B19: piccolo virus, (fonte) ha il virione composto da un singolo filamento a DNA. E’ l’agente della quinta malattia detta anche della “guancia schiaffeggiata” o anche eritema infettivo che si propaga ed infetta per via aerea, respiratoria, per contatto con secrezioni naso-faringee e può anche essere trasmessa al feto, in meno del 5% delle madri infettate nel I° trimestre di gravidanza, se non avviene un aborto spontaneo. Apparsa l’eruzione cutanea, la persona non è più infettiva.
14) Picornaviridae: pico, verosimilmente dallo Spagn., punta, cioè piccolo piccolo. Virus, come dice il nome, a monofilamento ad RNA. Questa famiglia comprende i rinovirus e gli enterovirus, che hanno un’uguale morfologia. Eccoli: rinovirus dal Gr. rhino, naso, attuano una replicazione nelle cellule mucosali delle coane (cavità nasali) e sono per lo più responsabili, insieme ai “buoni”
coronavirus, dei classici comuni raffreddori dell’autunno e della primavera ed enterovirus, entero-, dal Gr. enteron, intestino: dopo una prima stazione di replicazione faringea riescono a sopravvivere nello stomaco e nell’intestino, seconda sede di replicazione; pertanto l’infezione in genere si trasmette attraverso il contatto diretto con saliva, muco laringo-tracheo-bronchiale, feci e talora sangue. Il loro passaggio nel SNC consente di trovarli anche nel liquido cefalo-rachidiano (-> glossario) ed in ultimo, nell’ambiente contaminato come addirittura nelle acque potabili ed in quelle di balneazione (fonte).
Essi comprendono i coxsackie, gli echovirus, i poliovirus ed il virus dell’epatite A (HAV). Eccoli qua:
coxsackie, dal nome di una città dello stato di New York, questi virus molto contagiosi ad espressione citolitica, prediligono i bambini ed i mesi da agosto a ottobre per il clima favorevole; l’infezione richiede solo 2 giorni di incubazione. Si conoscono due sierotipi, il gruppo A con l’herpangina che provoca vescicole dolorose al cavo orale, alle mani e ai piedi che si ulcerano, ed il gruppo B, responsabile di dolori muscolari con spasmi, spesso toracalgie, insieme a febbre e a dispnea. Per il quadro clinico talora è indispensabile eseguire una puntura lombare rachicentesi (-> puntura lombare al glossario) per un’eventuale diagnosi differenziale con la meningite con gli esami appropriati, come la conta dei globuli bianchi presenti. Evidenze nel loro ruolo nei bambini nel provocare distruzione delle cellule beta del pancreas ad opera di linfociti T e macrofagi: ecco il diabete mellito giovanile insulino-dipendente quale malattia autoimmune;
echovirus rappresenta il più grande sottogruppo degli Enterovirus con 29 sierotipi, età pediatrica prediletta ed una serie di malattie, da lievi stati febbrili a gravi quadri potenzialmente fatali, come la meningite asettica, l’encefalite, varie tipologie di paralisi, miocardite;
poliovirus: dal Gr. poliós, grigio, poliomielite con myelós, midollo, col suffisso della infiammazione ed infezione –ite (-> poliomielite al glossario di Neurologia). E’ tra i virus più piccoli, 16 nm. e la sua replicazione inizia quando individua gli idonei recettori cellulari di superficie;
virus dell’epatite A (HAV): link splendido del Ministero della Salute.
Dico solo che si trasmette per via oro-fecale e non per via ematica o liquidi organici come per l’HBV e HCV e ricordo la trasmissione virale con le raccomandazioni delle 7 F in Inglese (link, -> poliomielite nel glossario). Ci si ricorda bene l’infezione da HAV a Napoli nel 2016 e la più grave l’anno seguente per inquinamento delle acque di mitilocoltura. Periodo medio di incubazione: 4 settimane.
Polyomaviridae: vedi papovaviridae.
15) Poxviridae: gruppo di virus dalla forma ovoidale con un
genoma a DNA, rilevabili in tutti i Popoli del mondo, affliggendo sia l’Uomo con il vaiolo, che nel solo XX° secolo ha ucciso circa 300 milioni di persone ed il mollusco contagioso, che animali con il termine di zoonosi, come la vaccinia o vaiolo bovino, infezione che interessa appunto tale bestiame causata dal virus che è stato loro iniettato al fine di ottenerne il vaccino. Il vaiolo umano ormai non esiste più in natura. Infezione come suddetto, causata dalle 7 “f”, comune decenni fa, oggi di riscontro preferenziale nei pazienti con AIDS da HIV.
17) Reoviridae: hanno il genoma a RNA. Possono interessare vertebrati, invertebrati, piante, protozoi e miceti. Nell’Uomo provocano lievi patologie gastrointestinali e respiratorie, mentre in età pediatrica possono provocare diarree severe.
18) Retroviridae: il termine proviene dal prefisso retro-, cioè la capacità di questi virus di trasmettere il loro RNA a monofilamento contenuto nel virione, al DNA del genoma della cellula ospite, integrandosi, grazie ad un enzima, la transcrittasi inversa. Splendida lettura al link del Ministero della Salute dell’1 agosto 2019. Accenno al fatto che la trasmissione della malattia avviene attraverso sangue e suoi derivati, liquido seminale, secrezioni vaginali e latte materno e nei primi anni ’80 l’evenienza di trapianti. Si ritiene che alcuni di tali virus siano responsabili di malattie linfoproliferative, come leucemie e linfomi (modulo n. 4, lezione n. 17) ed è ormai appurato il ruolo dell’HIV (Human Immunodeficency Virus) con la sua presenza nei linfociti T con loro severo calo numerico e quindi funzionale nei pazienti con AIDS, malattia pandemica con 32 milioni di morti dal 1981 al 1996, anno in cui si trovò una terapia antivirale che trasformò l’AIDS da pandemia ad infezione endemica. Nonostante i lustri trascorsi, l’HIV risulta tuttora peraltro fatale in certi contesti sociali a bassa educazione sanitaria, quindi welfare, con (fonte) circa 38.6 milioni di persone che convivono con la malattia in tutto il mondo.
Concludo: tutti i virus cancerogeni a RNA sono retrovirus (fonte);
19) Rhabdoviridae: è un virus neurotropo a singolo filamento di RNA con pericapside e glicoproteine, strumenti di ricerca, lo sappiamo, dei recettori idonei per “essere ospitati”. Utile valutare il link del Minitero della Salute. Io ne parlo nel glossario etimologico di Neurologia (-> idrofobia).
20) Rotaviridae: virus a RNA, molto contagioso, è attivo poche ore sulle mani, ma molti giorni su superfici non umide e compatte. E’ responsabile di una sindrome diarroica gastrintestinale frequentemente violenta e severa, soprattutto per la temibile disidratazione (fonte) nei bambini entro i 15 mesi di età. Il quadro clinico prevede febbre, vomito e diarrea ovviamente acquosa. La vaccinazione di routine può prevenire l’infezione da rotavirus.
VIRUS e CANCRO: si ritiene che circa il 10% – 15% (fonte) o addirittura il 20% (fonte) dei tumori sia correlato ad alcuni specifici generi di virus, fenomeno di trasformazione biologica definito oncogenesi virale che si esprime con una crescita incontrollata delle cellule e formazione di tumori benigni, come iperplasie, tipo verruche e condilomi, ma soprattutto maligni.
E ciò avviene poiché alcuni virus sono in grado di creare infezioni persistenti che possono stimolare, ecco l’oncogenesi, la cellula a proliferare in modo incontrollato: si inibisce l’apoptosi (morte cellulare programmata dal proprio DNA), vengono attivati geni mitogeni e si esaltano i comandi delle attività delle proteine (geni prescrittori) che regolano la proliferazione cellulare detti oncosoppressori: la crescita anarchica, incontrollabile e funesta.
Ricapitoliamo l’argomento sulla scorta della classificazione dei virus predetta e faccio un elenco, spiegando poi qualche altro termine appropriato al riguardo. 6 le famiglie interessate al problema Oncologico.
Flaviviridae: HCV con il colangiocarcinoma, un adenocarcinoma dell’epitelio delle mucosa delle vie biliari;
Hepadnaviridae: HBV con epatocarcinoma;
Herpesvidae: Herpes virus-8 (HHV-8) con sarcoma di Kaposi e l’HV di Epstein Barr con linfoma di Burkitt, carcinoma del rinofaringe, della regione prossimale dello stomaco (cardias e corpo), linfoma di Hodgkin e non Hodgkin;
Papillomaviridae: HPV con carcinoma spinocellulare (o squamoso o malpighiano) del collo (cervice) dell’utero, dell’ano, vagina, pene, vulva, orofaringe, tonsille e lingua.
Poliomaviridae: poliomavirus con carcinoma a cellule di Merkel. Ben 12 loro generi sono oncogèni.
Retroviridae: Human T lymphotropic Virus con leucemie e linfomi dell’adulto a Linfociti T.
Ho prima parlato degli ONCOGèENI: viene detto oncogèno un gene che determina la proliferazione cellulare anomala, non più controllata, e quindi anche il cancro con valenza aggettivale di cancerogeno.
Se sei interessato, vai alla lezione VIRUS, dove troverai:
Colony stimulating factors (CSF), Epidermal growth factor (EGF), Eritropoietina (EPO),
Fibroblast growth factors (FGF), HGF (Hepatocyte growth factor),IGF1 (Insulin growth factor) o somatomedina: (fonte). Un mio articolo sull’argomento, aggiornato al 2009, Nerve growth factor (NGF) o neurotrofina, Platelet-derived growth factor (PDGF), Trasforming growth factor (TGF-β), Vascular Endothelial Growth Factor (VEGF).
Infezioni virali persistenti ed oncogenesi sono pertanto una triste realtà.
Concludo la lezione con cenni sugli
ONCOSOPPRESSORI: anche qui, se sei interessato, vai alla lezione VIRUS.
CENNI di TERAPIA. Un sito splendido per questo argomento estremamente complesso ed in continua evoluzione è questo del 28 febbraio 2018 dell’Istituto Superiore di Sanità (link).

Organizzazione della lezione:
– 1) COSA SONO I MICETI (FUNGHI)
– 2) AMBIENTE e TROPISMO
– 3) DIMENSIONI, STRUTTURA e FORME
– 4) VIE di INGRESSO
– 5) NUTRIZIONE, FONTI di ENERGIA, RIPRODUZIONE
– 6) VIRULENZA e AZIONE PATOGENA
– 7) MICOSI di INTERESSE CLINICO:
– a) Patogeni primari
– b) Patogeni opportunisti
– c) Micosi superficiali o Tinee
– d) Micosi cutanee
– e) Micosi sottocutanee
– f) Micosi esogene
– g) Micosi sistemiche o profonde, esogene e endogene. Dimorfismo
– h) Genere di Funghi di interesse clinico, in ordine alfabetico.
Riferirò molto poco sui funghi che portiamo a tavola!
Anche il capitolo delle terapie lo trascuro, perchè estremamente specialistico e complesso.
– 1) COSA SONO I MICETI (o FUNGHI): 5 sono i regni biologici della natura: degli animali, delle piante, dei miceti, delle monère (sinonimo procarioti e batteri) e dei protisti, gruppo di organismi eucarioti, generalmente unicellulari, autotrofi o eterotrofi, con caratteristiche proprie sia delle piante che degli animali, eterogeneo e polifiletico, cioè senza un comune antenato, non inseribili negli altri 4 regni e senza tessuti altamente specializzati, come le alghe, il fitoplancton e i protozoi.
Il regno dei funghi comprende (fonte): funghi, lieviti, muffe o funghi filamentosi, spore,

carboni e ruggini (vedi avanti a – 3).
Sono organismi eucarioti, quindi provvisti di parete e nucleo, uni- o pluricellulari, aerobi obbligati o facoltativi, eterotrofi, come i batteri, come l’Uomo e tutti gli animali detti metazoi (animali che raggiungono durante lo sviluppo una condizione pluricellulare in grado di esprimere numerose funzioni vitali), si contrappongono ai protozoi che sono organismi unicellulari, ma anche loro eucariotici. Tale regno comprende molte decine di migliaia di specie, comprese quelle da tavola, eduli, con oltre 200 specie patogene per l’Uomo, alcune delle quali le vedremo nella – 7) MICOSI di INTERESSE CLINICO.
– 2) AMBIENTE e TROPISMO: i funghi vivono ovunque, cioè ubiquitari e li troviamo abitualmente nei boschi, parassiti di piante, di animali e di altri funghi (!), nei terreni, negli oceani, nelle acque costiere, sulle dune sabbiose con gli psammofili (ammos in Gr. sabbia), in pianura e ad altitudini fino a 2.500 m. s.l.m.. Altri sono saprobi o meglio saprofiti (dal Gr. sapros, putrido, marcio e bio, vita e phyton, pianta) vivono cioè decomponendo materia organica inerte, morta, contribuendo così al fenomeno della degradazione, scomponimento dei complessi organici. La maggior parte dei generi si trova in aree geografiche ben definite, verosimilmente in rapporto alla presenza dei mammiferi preferiti da infettare.
Per quanto riguarda il tropismo, si afferma che non esiste e tale concetto si può assimilare in modo un po’ anomalo, alla crescita periferica delle ife che cercano l’ambiente più favorevole, come le radici del mondo vegetale. I miceti non hanno movimento poichè sprovvisti di elementi dedicati al moto attivo.
– 3) DIMENSIONI, STRUTTURA e FORME:
Dimensioni: macromiceti: funghi mangerecci e funghi velenosi. Micromiceti: le forme microscopiche, da quelle di una singola cellula, circa, tra i 2 e i 40 micron, come per i lieviti (fonte),
a quelle delle spore (fonte) che variano dai 3 μm di Aspergillus e Penicillum, fino ad oltre 150 μm di Helminthosporium.
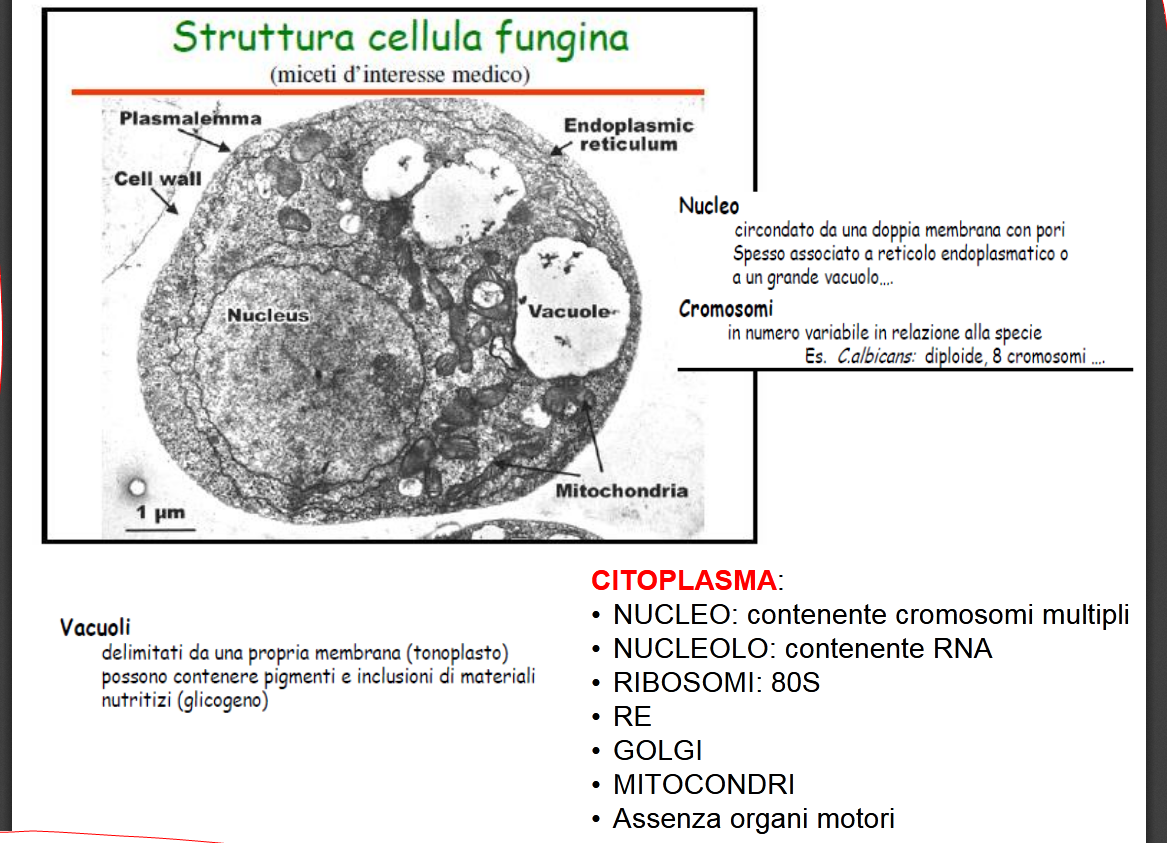
Strutture e forme: abbiamo detto all’inizio che i miceti comprendono funghi, lieviti, muffe, spore, carboni e ruggini. Come eucarioti, sono quindi provvisti di parete esterna o tunica, un esoscheletro regolatore della forma del fungo e del passaggio dell’acqua con proprietà antigeniche, compatto, rigido, pluristratificato e complesso costituito da numerosi polisaccaridi polimeri denominati β-glucani e chitina, polimero di un aminozucchero presente anche nell’esoscheletro degli artropodi (insetti, ragni, crostacei, vermi millepiedi) ma assente nelle piante (!),che risulta essere molto resistente alla fagocitosi ed alle molecole antimicotiche ed infine i mannani, polisaccaridi polimeri del mannosio, che si complessano con le proteine, contribuendo alla rigidità della parete e svolgendo funzioni fondamentali come quella antigenica e quella della adesione (vedi- 6) VIRULENZA e AZIONE PATOGENA ) alla cellula ospite.
Esternamente alla parete, e solo per il Cryptococcus neoformans (->), può esserci una
capsula di natura muco-polisaccaridica, più o meno spessa che rappresenta (fonte) un fattore di virulenza specialmente per i lieviti con valenza antigenica ed effetto pirogeno e tossico (vedi ancora -6).
Abbiamo quindi il
plasmalemma o membrana citoplasmatica formata da glicoproteine, fosfolipidi ed ergosterolo, steroide sul quale agiscono maggiormente gli antimicotici, il
citoplasma con nucleoli di glicogeno e di RNA, mitocondri, ribosomi per la lettura dell’RNA per la sintesi proteica, la
membrana nucleare a doppio strato poroso ed il
nucleo con DNA.
I funghi, tranne i lieviti monocellulari, generano con crescita vegetativa alle loro estremità un complesso di ife detto conidi, strutture pluricellulari, filamentose e tubulariforme corredate di mitocondri e glicogeno che formano il loro corpo vegetativo o micelio. Attraverso le ife, muffe e funghi in generale assorbono le sostanze nutritive. Appartengono a questo gruppo i lieviti, funghi commestibili, tartufi ed alcune specie marine.
Vediamoli in modo sintetico.
LIEVITI: organismi unicellulari di forma ovoidale o sferica, necessitano dell’aria, ma anche la sua assenza ha conseguenze sul loro sviluppo che vedremo più avanti (la fermentazione), per moltiplicarsi in maniera asessuata con la mitosi cioè la divisione cellulare o gemmazione per garantire l’unicità della
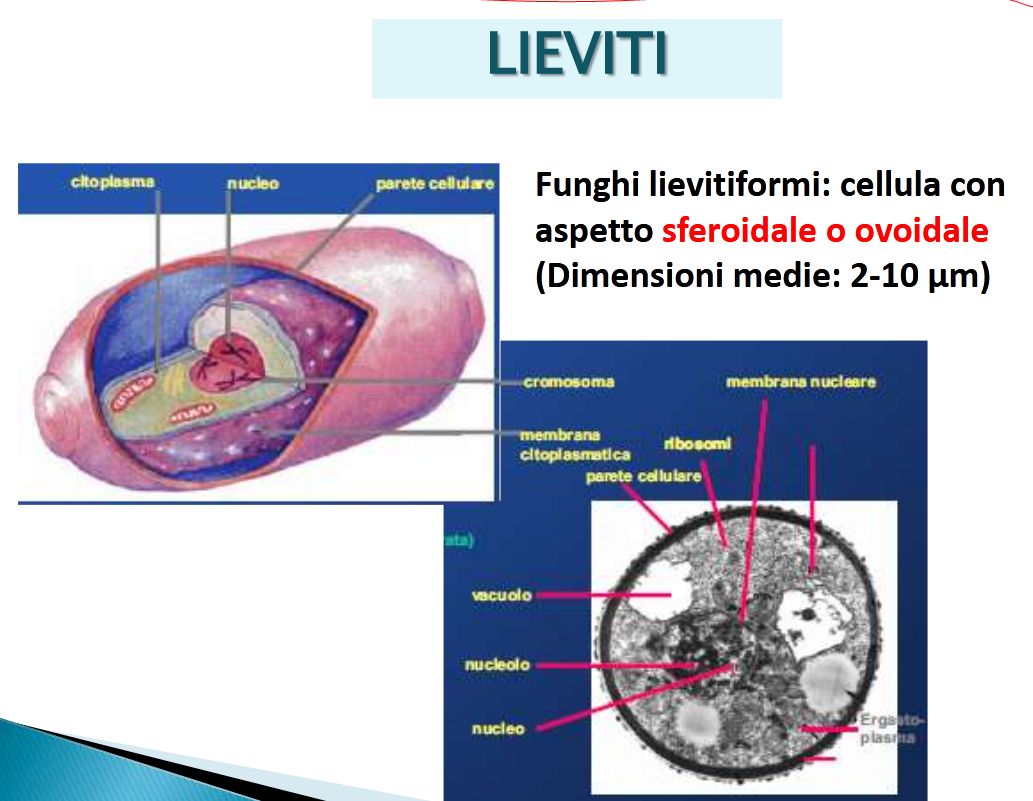
generazione (fonte) raramente per via sessuata con due genomi e quindi generazioni diverse.
La forma parassitaria tissutale dei lieviti si esprime alla temperatura anbientale di 37 °C. La diffusione dei lieviti negli organi e tessuti sembra essere favorita addirittura dalla fagocitosi dei monociti -> macrofagi, perchè in essi non sono digeriti, si sviluppano e si espandono con la morte degli ospiti.
La composizione di una cellula di lievito comprende una parete costituita da proteine, dai polisaccaridi beta-glucani e dalla chitina, amminozucchero simil cellulosa vista poco prima, una robusta e compatta membrana citoplasmatica ad alto contenuto di complessi proteici e chitina ed il nucleo con 16 cromosomi.
In aerobiosi i lieviti respirano (assumono O2) e si moltiplicano abbondantemente ovviamente senza produzione di alcol. Lo zucchero di cui si nutrono è trasformato in anidride carbonica e acqua con il noto fenomeno della glicolisi aerobica (che io chiamo “formula della vita”, modulo n. 3, lezione n. 11) ed ampia produzione di ATP, l’energia vitale!
MUFFE o FUNGHI FILAMENTOSI o IFOMICETI: sono (fonte) organismi pluricellulari, agglomerati di ife, elementi strutturali filamentosi intrecciati “a rete” che rappresentano il loro corpo vegetativo, il micelio o tallo, dai quali prende l’aspetto ed i colori che
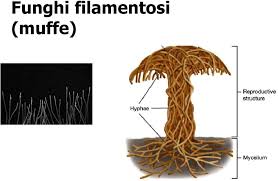
variano a seconda delle spore e delle condizioni ambientali favorevoli, come interni trascurati, caldi, umidi non aerati e senza luce solare.
SPORE: già nominate nelle muffe, sono piccolissime cellule disidratate, caratterizzate da una formidabile resistenza alle avversità ambientali. Nascono dalle ife, loro apparato vegetativo prendendo il nome di conidi, già detto, si liberano dalle colonie nell’ambiente favorevole e si disperdono nell’aria con i venti e le correnti per poi depositarsi praticamente ovunque, ma con sviluppo del tipo fungino nell’ambiente ideale per ogni tipo di spora (vedi -2, AMBIENTE).
Allo stato vegetativo si definiscono conidi (dal Gr. kònis, polvere e dal suffisso diminutivo idion, piccolo, cioè polverina), struttura riproduttiva asessuata. Oltre a potersi tramutare in lieviti, le muffe nei confronti dell’Uomo hanno un potenziale patogeno allergico, con produzione quindi di anticorpi IgE, (vedi -6, virulenza) o tossico; la forma saprofitica predilige i 25 °C ambientali.
La sporogenesi è la loro modalità di riproduzione: esse si formano per agglomerati di microscopiche spore estremamente resistenti in sospensione nell’aria. Una volta che si depositano negli ambienti favorevoli suddetti, ma anche alimenti, mobili, libri indumenti ecc., le spore germinano e velocemente si riproducono, riconoscendole prima per la comparsa delle ife come minimi puntini colorati o neri e quindi come vere macchie scure “a mollica di pane” o “spugnose” che sono gli agglomerati di miceli. Le muffe sono responsabili della produzione di micotossine (vai a -6) VIRULENZA).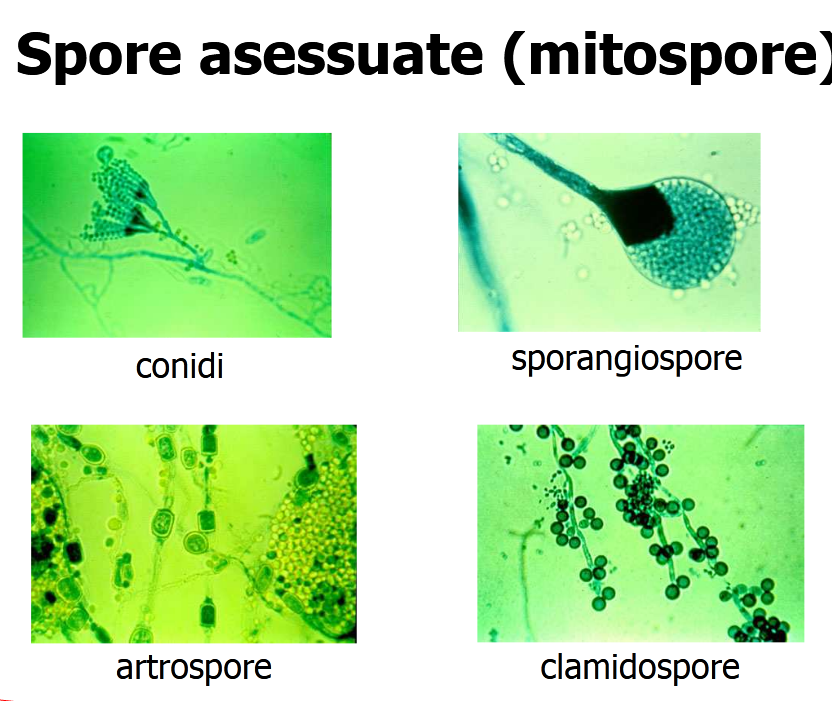
spore asessuate (fonte)
CARBONI: parassiti delle piante.
RUGGINI: sono funghi anche loro parassiti di piante e fiori, non patogeni.
Una precisazione: esistono numerosi esempi di dimorfismo fungino che è la capacità di alcune specie (fonte) di modificare reversibilmente la loro espressione morfologica, passando dalla forma filamentosa (muffa) a quella unicellulare (lievito) in base a variazioni ambientali, soprattutto termiche. Esempio delle muffe -> lieviti a 37°C e lieviti -> muffe a 25°C: tale passaggio intermittente dalla forma di lievito a quella di ife crea una varietà (pleiomorfismo) antigenica che inibisce, “sconcerta” la risposta immunitaria dell’ospite e questo fenomeno è caratteristico della Candida spp., dell’Histoplasma capsulatum, del Penicillum marneffei e della Sporotrix schenkii (per questi 4, ->- 7) MICOSI di INTERESSE CLINICO: – h).
– 4) VIE di INGRESSO: per un fungo la capacità di parassitare un essere umano SANO è relativamente raro, non per piante, animali e alghe. Queste le vie di ingresso.
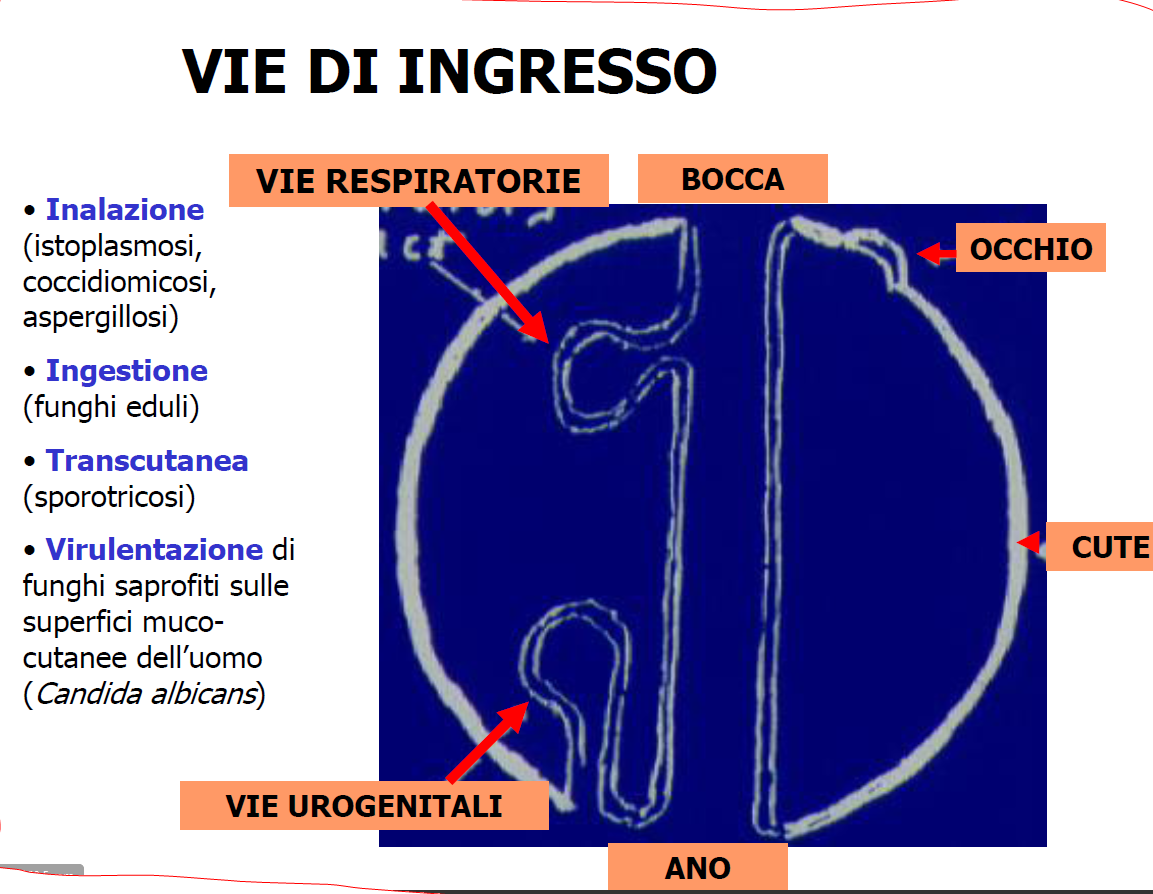
– 5) NUTRIZIONE, FONTI di ENERGIA, RIPRODUZIONE: come visto in -3), muffe e funghi in generale assorbono le sostanze nutritive attraverso le ife con varie proprietà (fonte), tutte finalizzate al proprio nutrimento con l’assorbimento post-lisi enzimatica ad opera di molecole da loro sintetizzate, chiamate enzimi digestivi, impiegati per degradare la materia organica così assimilabile. E allora, come si organizzano i miceti per reperire cibo e quindi Energia? Ciò avviene attraverso 3 vie: come
saprofiti, già visto, come;
commensali: traggono beneficio dall’organismo con cui vivono in stretto contatto, senza danneggiarlo;
parassiti scegliendo animali, piante e persino altri funghi (cannibalismo) vivendo adesi o al loro
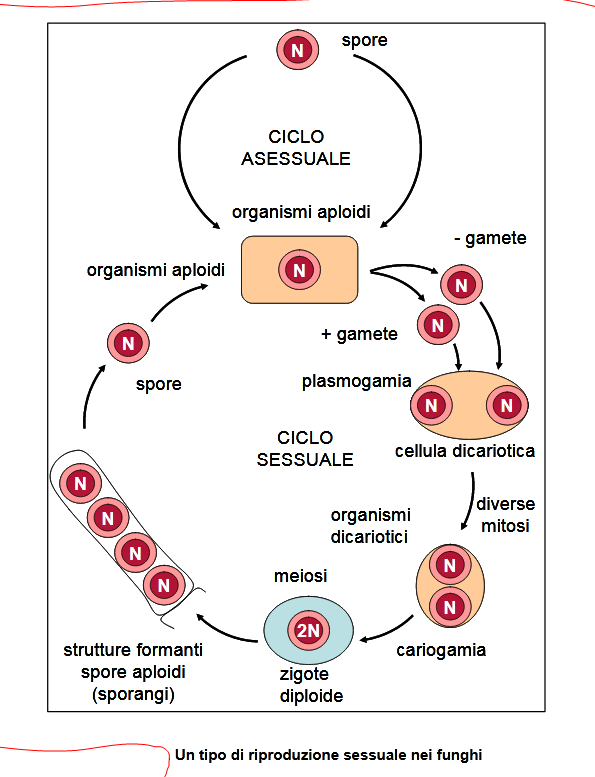
interno, danneggiandoli;
simbionti o per simbiosi: vivono insieme ad altri organismi, traendone vantaggi. Alcune specie hanno sviluppato complesse “convivenze” con organismi fotosintetici.
Così, trovata la fonte energetica (fonte) i miceti si riproducono in maniera sovrapponibile a quella delle piante e dei batteri anaerobi, cioè tramite le spore.
Il fenomeno avviene pertanto in maniera sessuata, attraverso la fusione di due o più nuclei come avviene per i funghi superiori, macroscopici, o in modalità asessuata o vegetativa, la più frequente, attraverso la germinazione (o germogliazione) della cellula madre che produce una cellula figlia più piccola.
Le riserve energetiche sono rappresentate dai polisaccaridi (fonte) che i funghi possono accumulare, analogamente agli animali, sotto forma di glicogeno (polimero di glucosio), diversamente dai vegetali che utilizzano l’amido, il C6H10O5 con n, polimero.
– 6) VIRULENZA e AZIONE PATOGENA. La maggior parte delle specie fungine (fonte) che causano patologie nell’uomo proviene da sorgenti esogene, ambientali. Solo le specie di Candida appartengono alla microflora umana, dove il fungo può rimanere anche per molto tempo inattivo, oppure può moltiplicarsi senza fare danno: è il fenomeno della colonizzazione.
Tra milioni di specie fungine poche soddisfano le 7 condizioni di base necessarie, i fattori di virulenza, per infettare o intossicare l’uomo.
1) tolleranza alle temperature corporee o termotolleranza: da -5°C a 60°C, ma per quelle di interesse clinico va da 22 a 37,5°C circa, con il massimo nelle Candide e nell’Aspergillus fumigatus, che prosperano anche a temperature corporee di 39 – 40 °C.;
2) adesione o adesività: è un fenomeno multifattoriale, meccanismo fondamentale nell’attività dei miceti opportunisti. Può avvenire secondo due modalità fondamentali (fonte), aspecifica con cariche elettriche di superficie, e specifica dei recettori cellulari dell’ospite con le adesine, specifiche molecole di adesione (fonte) che rappresentano veri e propri fattori di virulenza correlati alle strategie da tropismo biochimico, non esistendo una possibilità di locomozione fungina, come per i virus, presente invece nei batteri. Fondamentalmente tali molecole si legano chimicamente con un fosfolipide complesso alla parete cellulare e vengono in essa incorporate. Questo “attacco” nel vero senso della parola consente la successiva invasione grazie all’ifa che si ancora alla cellula ospite, esercitando una pressione penetrante favorita dal turgore della sua punta e, penetrata, è in grado di rimanere in quel luogo;
3) capacità di invadere l’ospite umano (infezione): avviene ad opera dei propaguli, agenti infettivi del micelio, spore con i conidi (dal Gr. kònis, polvere), o mitospore (da mitosi) presenti all’estremità delle ife con i fenomeni della inoculazione e penetrazione che consente l’ingresso. Questo avviene per due vie: attraverso la cute come le ife soprattutto dei lieviti con le loro estremità compatte e appuntite nell’Uomo e negli animali e per via aerea (droplets, tanto nominate in epoca di Covid-19) con minuscoli propaguli rotondi. Dopo l’ingresso può seguire o meno la fase della colonizzazione distrettuale (loco-regionale) e della disseminazione sistemica per via ematica o linfatica dopo un congruo periodo di incubazione;
4) capacità di sopravvivere e permanere negli organi e nei fagociti (che ricordo essere i granulociti neutrofili ed i monociti dalla linea rossa o mieloide del midollo rosso ed i linfociti Natural Killer dalla linea linfoide, provenienti dai linfociti B attivati): grazie al dimorfismo muffa-> lieviti -> muffe, si può quindi esprimere la patogenicità in condizioni ambientali a loro favorevoli e versatili! Anche le dimensioni relative hanno la loro valenza di virulenza, in quanto le maggiori dimensioni dei miceli li preservano dalla fagocitosi mentre nella fase di lievito alcuni miceti sono in grado di sopravvivere all’interno dei granulociti neutrofili, che hanno un diametro di circa 10- 20 μm (micron, un millesimo di mm.). Questo inserimento cellulare può rappresentare un mezzo per la diffusione di un’infezione. Il dimorfismo porta anche ad un polimorfismo antigenico come avviene per la Candida albicans nel suo tubulo germinativo delle ife che può essere in grado di “stupire, imbrogliare” e quindi invalidare l’eventuale risposta immunitaria precedente.
Le specie con dimorfismo più influenti clinicamente (per le caratteristiche vai a – h), genere (e specie) di funghi di interesse clinico): Coccydioides immitis, Histoplasma capsulatum, Blastomyces dermatitidis, Paracoccidioides brasiliensis, Paracoccidioides marneffei e Sporothrix schenckii e alcuni funghi opportunistici come Candida albicans e Penicillium marneffei;
5) digerire per lisi enzimatica e assimilare gli elementi biochimici dei tessuti umani (o di altri ospiti) è fondamentale: l’ospite (o vittima!) è la fonte, il substrato dal punto di vista nutrizionale con particolare riguardo al ferro (fonte), necessario sia alla respirazione (elaborazione con l’O2, come negli animali) fungina che nei processi enzimatici critici.
Ricordo 7 + 1 enzimi ad azione dannosa sulla membrana cellulare dell’ospite provocando la denaturazione delle proteine. Il passo successivo è quello di assorbire le molecole provenienti dalla digestione dei tessuti ospiti. Queste abilità biochimiche sono i reali mediatori dell’invasività micotica, organizzatissima;
6) resistenza al sistema immunitario; induzione di allergie (ipersensibilità immunitaria o atopia). Qui, già detto, l’invasione fungina è rara nei soggetti sani mentre predilige pazienti con immunodepressione, come già li abbiamo più volte enumerati. (Vai avanti a patogeni primari per l’elenco che ho fatto, credo abbastanza preciso. Accetto ben volentieri consigli) nei quali le terapie causali risultano essere estremamente complesse e dai risultati non sempre soddisfacenti in quanto l’elemento “fagocitosi” viene ad essere debole o praticamente assente, sia per la consistenza della capsula di polisaccaridi, presente in realtà solo nel perfido Cryptococcus neoformans, che per la debolezza dell’attivazione dei linfociti T per il comando ai linfociti B per la produzione di anticorpi da parte delle plasmacellule. (Al riguardo vi ricordo la lezione n. 5 del modulo n. 2 sul SANGUE).
Esempio classico al riguardo è l’Aspergillus fumigatus, che oltre a produrre un’aflatossina, con la sua gliotossina (fonte) esercita attività antimicrobica e immunodepressiva per induzione dell’apoptosi (dal Gr. ἀπό, apo, da e πτῶσις, ptosi, caduta, è la morte programmata, naturale delle cellule, ma qui si induce il “suicidio“) dei fagociti.
Altro fattore, quello dimensionale, che è elevato per i conidi che impediscono alle ciglia dell’epitelio respiratorio di bloccarli, immergerli nel muco ed eliminarli con la tosse.
Con la Candida albicans abbiamo altre caratteristiche al riguardo: adesione e formazione di biofilm (fonte) (come avviene anche con i batteri e non con i virus), da parte delle ife, mix extracellulare di polisaccaridi che come una pellicola riveste colonie di microrganismi, qui funghi. Le sue funzioni sono quelle di trattenere acqua e nutrienti, di proteggere dalle attività immunitarie e dai cambiamenti dei parametri ambientali, garantendo così un’omeostasi.
Ed ancora un altro esempio: con il Criptococcus neoformans si ha inibizione della migrazione leucocitaria e della fagocitosi.
Ipersensibilità: si hanno reazioni allergiche (fonte) ad antigeni delle spore e muffe clinicamente evidenziabili con polmonite da ipersensibilità (iperattività non fisiologica, detta anche atopia) con rinite, asma e alveolite.
7) produzione di micotossine e loro ingestione: le micotossicosi. Un po’ fuori tema, ma tali tossine sono prodotte dalle muffe come metaboliti secondari in determinate condizioni ambientali non igieniche. Il termine micetismo indica l’avvelenamento da funghi velenosi, la micotossicosi è l’avvelenamento da prodotti alimentari contaminati dalle suddette molecole alcune delle quali hanno anche effetti mutageni, cancerogeni e teratogeni.
Per le aflatossine ed altri metaboliti implicati vai alla lezione sui MICETI.
– 7) MICOSI di INTERESSE CLINICO.
Una sistematica e didattica esposizione dell’argomento è estremamente difficile, perchè complesso.
Organizzazione dell’argomento. Voci:
– a) Patogeni primari
– b) Patogeni opportunisti
– c) Micosi superficiali o Tinee
– d) Micosi cutanee
– e) Micosi sottocutanee
– f) Micosi esogene
– g) Micosi sistemiche o profonde, esogene o endogene. Dimorfismo
– h) Generi di Funghi di interesse clinico: in ordine alfabetico.
Le specie di seguito nominate sono sinteticamente descritte in ordine alfabetico alla fine di questo articolo.
Le infezioni micotiche NON sono contagiose, tranne le dermatofizie e le candidosi.
– a) PATOGENI PRIMARI: possono determinare sempre infezioni, sia nell’ospite sano, tanto più nel Paziente immunodepresso e di solito hanno ben definite aree geografiche di azione. Sono: Blastomycosis dermatitidis, Coccidioides immitis e C. posadasii, Criptococco neoformans, Histoplasmosis capsulatum, Paracoccidioides brasiliensis (->). Nel Madagascar, le cromoblastomicosi (-> micosi sottocutanee)
![]()
E’ questo allora il momento di fare un elenco delle categorie dei Pazienti immunodepressi o a rischio di immunodepressione, già descritto nel modulo n. 2, lezione n. 5 sul SANGUE che qui

riporto e che vi prego di ricordare:
le immunodeficienze neonatali e le malattie autoimmuni gravi acquisite, come i Pazienti con AIDS, gli Oncologici soprattutto se sotto chemioterapia (TCX, chemioterapia antiblastica) o in Radioterapia estesa ed i trapiantati soprattutto con cellule staminali a causa delle terapie immuno-soppressive, nelle leucemie e linfomi, i politrasfusi, i soggetti in stress (stress compagno di vita) acuto e cronico, (modulo n. 17, lezione n. 41 sul Sistema psico-neuro-immuno-
endocrino), gli anziani avanzati in scarse condizioni igieniche, deficit ormonali, quelli con MOF (Multi Organ Failure o sindrome da deficit multiorgano), i politraumatizzati, i Pazienti di Chirurgia avanzata ampiamente demolitiva e ricostruttiva, alcolisti cronici e malnutriti anche e spesso in Ospedale (!) quale patologia iatrogena (modulo n. 6, lezione n. 22). I cateteri venosi centrali (CVC) e gli stent biliari, endocoledocici a permanenza o presenti per tempi molto prolungati possono essere elementi favorenti le infezioni sistemiche, valutando anche la diagnosi e l’eventuale fragilità del paziente (le famose condizioni cliniche preesistenti), molto meno gli altri presidi come il C.V., gli stent ureterali, uretero-pielici, drenaggi biliari o trans-epatici esterni, drenaggi liquor cerebrale-peritoneo ed infine tubi per alimentazione enterale artificiale gastro-digiunali.
– b) PATOGENI OPPORTUNISTI: infezioni fungine frequenti solo quando l’ospite è nelle suddette situazioni immunitarie patologiche con passaggio dalla fase di commensalismo a quella di parassitismo patogeno. Ecco gli opportunisti più importanti: Aspergillus fumigatus, Candida albicans, Cryptococcus neoformans, Fusarium, Penicillium marneffei, Pneumocystis jirovecii, Trichosporon beigelii, Zygomycetes (tutti ->).
– c) MICOSI SUPERFICIALI: sono infezioni presenti principalmente ai Tropici, limitate all’epidermide, lo strato esterno della cute, ai capelli, peli ed alle unghie con nulla o scarsissima reazione immunitaria da parte dell’ospite. I funghi interessati: il Malassezia furfur (anche viscerale pancreatica (vedi -> SPECIE) e varie spp di Ascomyceti (->).
d) MICOSI CUTANEE o TINEE (o TIGNE): parliamo delle dermatofitosi con sinonimo più idoneo di dermatomicosi. Tali dermopatie sono determinate da funghi appartenenti a 4 generi detti dermatofiti patogeni per l’Uomo e per gli animali: Epidermophyton, Lophophyton,
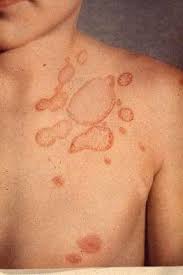
Microsporum e Trichophyton (anticipo la frequente Tinea capitis), generi definiti anche cheratinofilici il cui habitat è il suolo dove elaborano cellule della cute e peli animali ed umani eliminati, esfoliati e depositati nell’ambiente. La loro patogenicità si esplica invece crescendo e degradando la cheratina delle cellule epiteliali dello strato corneo della cute, dei capelli, peli, unghie o artigli di persone e animali viventi. Essi si comportano quindi come saprotrofi o saprofiti non invasivi, ma la loro crescita provoca irritazione e infiammazione delle cellule epiteliali sottostanti espressione di una reazione allergica (quindi con produzione di anticorpi, diversamente dalle intolleranze) che può causare la morte di queste cellule. Clinicamente avremo pertanto le classiche croste, desquamazioni e alopecia.
– e) MICOSI SOTTOCUTANEE: la via di ingresso è da lesioni cutanee, anche minime.
Sono un gruppo di complesse e svariate infezioni del derma, sottocute, muscoli, fasce aponeurotiche e non di rado, nelle forme avanzate, anche delle strutture ossee, che possono pertanto diffondersi localmente per contiguità ed anche per via linfatica o addirittura per via sistemica, dovute a funghi saprotrofici del terreno, abituali delle regioni tropicali e subtropicali del Sud America, Indonesia, India ed Africa. Intuitivo dire che la maggior parte delle persone coinvolte cammini a piedi nudi o che ci si possa ferire alle mani o braccia, anche in modo lieve, apparentemente “innocente”, ma con materiale inquinato; altro dato importante è la sostenuta reazione immunitaria del Paziente con un’importante produzione di anticorpi IgM, cioè attuali, le IgG sono quelle di memoria, cioè pregresse.
Le manifestazioni cliniche da considerare con i rispettivi patogeni sono 4:
– micetoma (tumore da fungo) noto come “piede di Madura” con i responsabili: Madurella
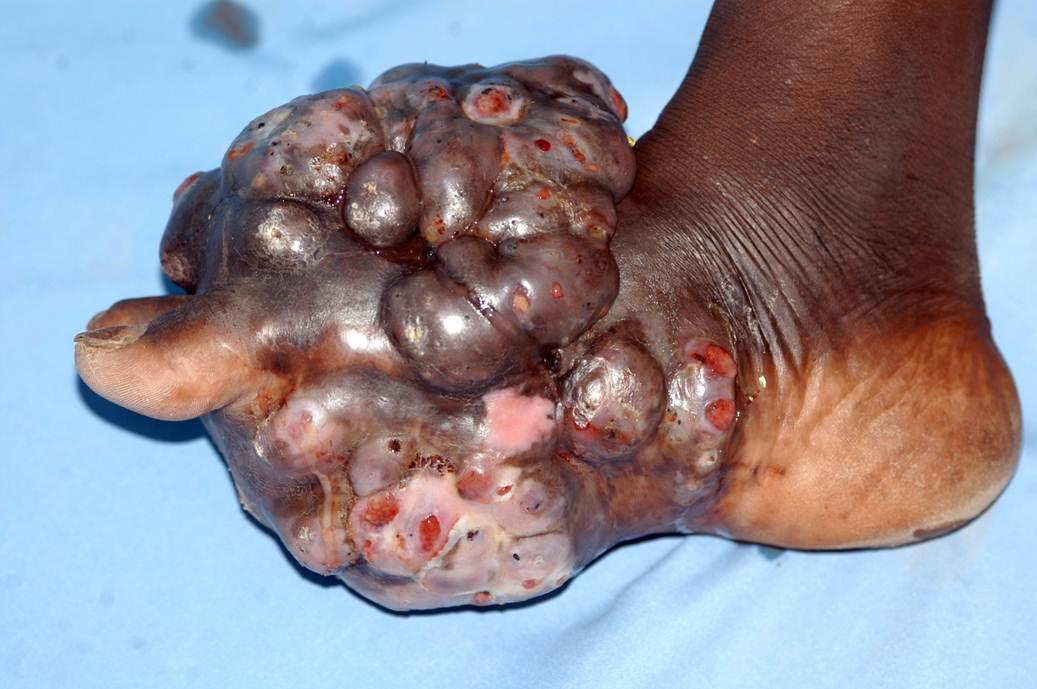
mycetomatis e M. grisea, ascomiceti filamentosi. Qui l’unica terapia è chirurgica, demolitiva (!);
– sporotricosi da Sporothrix schenckii, Ascomiceta (->), la cui espressione patologica è la “malattia del gestore di rose” il giardiniere, da locale a sistemica, drammatica;
– cromoblastomicosi è un’infezione cutanea (fonte) che colpisce persone normali anche dal punto di vista immunitario preferibilmente delle zone tropicali o subtropicali con il Sud del Madagascar in prima linea che si pungono o feriscono, anche minimamente, con spine e schegge che albergano questi funghi. L’infezione è caratterizzata dalla formazione di noduli papillomatosi, verrucosi iperplastici che tendono a ulcerare, da funghi demaziacei;
– feoifomicosi sono rare infezioni, sempre da funghi pigmentati (con melanina) demaziacei dei tessuti cutanei, superficiali e profondi, in particolare del cervello dove si formano cavità cistiche, prediligono soggetti immunocompromessi ed ovviamente sono talora fatali.
– f) MICOSI ESOGENE: causata da miceti ambientali presenti nel terreno, sui vegetali, nelle acque, come i cosiddetti Saprobi (etimo già detto: dal Gr. σαπρός, putrefatto, corrotto e βίος, vita) vocabolo che indica organismi che vivono in ambiente con materiale organico in decomposizione. Le patologie: Aspergillosi, Criptococcosi, specie Dimorfi con l’Histoplasmosi in primo piano.
– g) MICOSI SISTEMICHE o PROFONDE, ESOGENE e ENDOGENE: ne parlo insieme per evitare sovrapposizioni di patogeni e clinica.
Qui massima reazione immunitaria da parte dell’ospite, modesta invece se immunodepresso. Le micosi profonde sono causate da agenti patogeni fungini primari e opportunistici, ESOGENI o ENDOGENI, che inizialmente colonizzano il polmone, per poi diffondere in altri organi come cervello, cuore, fegato, milza, surreni e reni. I funghi responsabili sono: Blastomyces dermatitidis, Coccidioides, Histoplasma capsulatum e Paracoccidioides brasiliensis.
Gli opportunisti, che causano micosi profonda e malattia disseminata, percorrono ed invadono l’organismo attraverso il tratto respiratorio, il tratto alimentare o i dispositivi intravascolari e sono: Blastoschizomyces capitatus e Trichosporon spp. con il T. asahii, il responsabile più aggressivo e frequente, lieviti che causano nei neutropenici (ricordo che i granulociti neutrofili sono splendidi fagociti della linea midollare rossa!) infezioni disseminate talora mortali, Aspergillus spp. (spp = specie) , Candida spp, Malassezia furfur, Talaromyces o Penicillium marneffei.
Specialmente nei pazienti neutropenici (fonte), varie muffe ambientali, comprese le specie di Fusarium e Scedosporium apiospermum, che sono sempre più frequenti, possono causare lesioni vasculitiche angioinvasive focali, (ragazzi, ricordatevi l’Amico Virchow con la trombofilia!, modulo n. 3, lezione n. 11) che ricordano molto l’aspergillosi invasiva).
La maggior parte dei casi di micosi profonde primarie sono infezioni asintomatiche o clinicamente lievi che si verificano in pazienti normali che vivono o viaggiano in aree endemiche. Tuttavia, i pazienti esposti a un elevato inoculo di organismi o quelli con difese alterate possono subire una progressione potenzialmente letale o la riattivazione di focolai latenti di infezione.
I principali agenti patogeni sistemici: Aspergillus spp, soprattutto fumigatus, Blastomyces dermatitidis, Coccidioides immitis, Histoplasma capsulatum, Paracoccidioides brasiliensis.
I funghi dimorfici: Blastomyces dermatitidis, Coccydioides immitis, Histoplasma capsulatum, Paracoccidioides brasiliensis, Penicillium marneffei, Sporothrix schenckii e alcuni funghi opportunistici come Candida albicans e Penicillium marneffei.
– i) Genere di FUNGHI di interesse clinico, in ordine alfabetico.
Ascomycetes: dal Gr. ascos, sacco, dove alloggiano le spore, acospore, è una classe di funghi filamentosi, con micelio di norma pluricellulare, agenti della maggior parte delle micosi umane
comprendenti circa (fonte) il 75% di tutte le specie di funghi catalogati compresi i tartufi, la maggior parte dei patogeni delle piante e quelli che si associano ad alghe o a cianobatteri per formare i licheni. Comprende: Aspergilli spp, Epidermophyton, Madurella mycetomatis e M. grisea, Microsporum, Sporothrix shenckii e Trichophyton.
Aspergillus spp.: miceti filamentosi della classe degli Ascomiceti (-<), ad ampia diffusione ambientale, comprendente 3 generi principali (fonte): fumigatus, la specie clinicamente più importante, A. niger ed A. flavus. Il fumigatus è la specie responsabile di circa il 90% delle aspergillosi sistemiche con polmonite letale, o granulomi, l’aspergilloma, ma anche, nel decorso clinico tremendo, implacabile, con sinusite che avanza nel massiccio facciale con ascessi cerebrali nei pazienti neutropenici e con monocitopenia: da qui il fallimento di offrire un’efficace risposta immunitaria. Termofilo, cresce egregiamente a temperature di 39 – 40 °C. Il loro micelio con ife specializzate, produce i conidi, piccole cellule disperse nell’aria, stabili nell’atmosfera e capaci di entrare negli alveoli umani. Invadendo i vasi sanguigni, le ife dell’Aspergillus provocano trombi (lesione dell’endotelio e trombosi: Virchow Amico, ricordatelo!) con infarto del tessuto a valle, fenomeno drammatico soprattutto nei trapiantati, con ovvi e gravi episodi di rigetto.
Blastomycosis dermatitidis: è un lievito opportunista (fonte) che vive in ambienti umidi su terreni con legname e foglie in decomposizione, in USA e Canada. Le spore vengono inspirate con decorso di solito cronicizzante. L’organismo reagisce con una reazione granulomatosa spesso associata a una marcata reazione fibrotica. La diffusione avviene più comunemente su cute, ossa e prostata. Granuloma: neoformazione benigna di natura infiammatoria cronica caratterizzata da un nucleo centrale necrotico, da una corona di macrofagi, neutrofili e linfociti, connettivo e capillari neoformati con una capsula di tessuto sclero-cicatriziale prodotta dai fibroblasti.
Candida spp: (Monilia, sinonimo, termine obsoleto): sebbene esistano oltre 200 specie di Candida, cinque delle loro diverse specie causano il 90% della candidosi sistemica con peculiarità del dimorfismo, che spesso blocca la funzione fagocitaria dei macrofagi (!) e sono: Candida tropicalis, C. parapsilosis, C. glabrata, C. krusei, che relativamente spesso ho ritrovato negli esami colturali dell’apice del CVC (catetere venoso centrale) di pazienti febbrili, ma dopo la più frequente Candida albicans, clinicamente la più rilevante perchè più comunemente isolata e soprattutto patogena, commensale umano nei distretti preferenziali, rappresentati da cavo orale in aerobiosi, adattandosi in modo eccellente alla mucosa del tratto gastro-intestinale ad alto pH ed in anaerobiosi e a quella della vagina, a basso pH. E’ dimorfo, presentandosi come lievito e ife. È in grado di crescere bene a temperature febbrili umane di 39 ° C-40 ° C (come l’Asp. fumigatus). Può penetrare nei tessuti ospiti con cellule ifali e ha molteplici molecole di adesione per facilitare la loro azione di perforazione della punta. Una serie di enzimi litici adatti alla digestione delle macromolecole umane viene indotta durante l’invasione dei tessuti.
A livello cutaneo le sue infezioni invadono profondamente l’epidermide e gli annessi cutanei: unghie, capelli e peli con importante reazione immunitaria da parte dell’ospite.
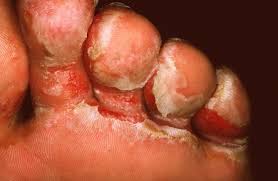
Le lesioni (fonte) appaiono come chiazze ben circoscritte, rosse, a volte pruriginose di varie dimensioni e forme, generalmente cerchiate con piccole pustole a base rossa e compaiono comunemente in pliche della cute come le ascelle, sotto il seno, dell’addome detto pendulo e del gomito, in area periombelicale, alle pliche dell’inguine, tra quelle dei glutei come nella dermatite da pannolino o pannolone, tra le dita dei piedi per l’umidità (!!!) ed infine intorno all’ano, denominata candidosi perianale. Croste possono formarsi anche sul cuoio capelluto e l’infezione può diffondersi anche al viso.
Intorno alle unghie (paronichia da candida). Questa infezione inizia di solito come un gonfiore doloroso che successivamente genera pus a livello subunguale talora con perdita delle unghie delle mani o più frequentemente dei piedi.
Candidosi orale, il mughetto: di solito appare dapprima come chiazze o piaghe bianche
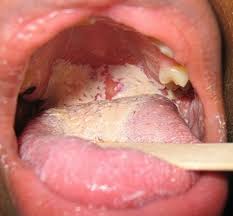
cremose sulla lingua o sulle mucose della bocca. Se interessa le commissure labiali, arrossate per flogosi e infezione, erose e screpolate, si parla di perlèche.
Vulvovaginite: le donne in gravidanza o con diabete sono particolarmente esposte a questa comune infezione fungina. Di solito appare prima come una densa secrezione vaginale bianca o gialla (leucorrea) dall’odore dolciatro di lievito, con prurito e arrossamento dei genitali. Comunque l’agente più frequente di questa patologia è il batterio Trichomonas Vaginalis.
Pene: l’infezione del glande, sul solco balano-prepuziale, non è rara nei pazienti con fimosi e diabete ed in quelli con partner sessuali portatrici di vulvovaginite da candida.
A livello sistemico la candidosi invasiva assume molte espressioni cliniche a seconda del contesto in cui un ospite si ammala, poiché, una delle cause importanti è che il lievito non è più dominato dai batteri “buoni” del microbiota per mortificazione della flora batterica normale da parte degli antibiotici ad ampio spettro spesso purtroppo da patologia iatrogena (!) (modulo n. 6, lezione n. 22) con severe criticità nel Paziente.
I principali fattori di rischio in tale contesto sono l’uso di cateteri venosi centrali, l’esposizione ad antibiotici ad ampio spettro come detto prima, senescenza soprattutto con alcolismo e malnutrizione, ricoveri ospedalieri di lunga durata, diabete mellito, gravidanza; anche i neonati possono essere infettati dalla madre malata ed infine la neutropenia o agranulocitosi (modulo n. 3, lezione n. 10), fenomeno non raro nei pazienti oncologici in TCX per la possibile trasmigrazione intestinale della Candida nel sangue portale e quindi ascessi epatici, ma non cerebrali, fenomeno questo rilevabile invece nei neonati prematuri con candidosi data la loro immaturità della barriera ematoliquorale, permeabile.
Clinicamente si assiste (fonte) ad un amplissimo spettro di infezioni da lieviti di diverse specie di Candida. È una grave infezione piuttosto comune nei pazienti a lungo ospedalizzati che con la candidemia può raggiungere l’endocardio, il cervello, la retina, fegato e milza, reni e surreni, di rado provoca osteomielite o altro di rarissimo.
Comunque la forma più comune e grave, come detto prima, anche per la tipologia complessa del Paziente, e la diffusione, è la candidemia la cui sindrome (insieme di segni e sintomi) comprende febbre, ovviamente non rispondente agli antibiotici, brividi, ipotensione, conta dei leucociti poco affidabile per < o >, più l’impegno dell’organo maggiormente colpito. Peculiarità già prima riportata: la Candida prospera anche a temperature corporee di 39 – 40° C. ed un altro dato fondamentale (fonte) è che riesce a “camuffare”, fenomeno detto resistenza, un suo recettore parietale per eludere l’attività dei macrofagi e forse anche quella dei granulociti neutrofili, che amano però preferenzialmente i batteri. Una cosa è certa (fonte): non esiste correlazione tra candida e cancro. Forse qualcosa è da capire per il cancro del pancreas e la presenza di funghi del genere Malassezia (->) nel suo parenchima di provenienza dal microbiota intestinale.
Coccidioides immitis e C. posadasii: sono funghi (fonte) del suolo negli USA e nell’America del Sud e la coccidioidomicosi o Febbre della Valle è una malattia polmonare per inspirazione delle spore o a diffusione ematogena disseminata, di solito a carattere benigno. Tuttavia, eccezionalmente, alcuni pazienti immuno-compromessi affrontano un’infezione polmonare progressiva e possono anche presentare diffusione al cervello, alle ossa e ad altri siti. La meningite da coccidioide è un’infezione potenzialmente letale che richiede un trattamento permanente.
Cryptococcus neoformans: è un saprofita molto diffuso nell’ambiente, abbonda negli escrementi e nelle carcasse di piccione ed è l’unico fungo provvisto di una spessa capsula polisaccaridica, importante fattore di virulenza. La Cryptococcosi può presentarsi come semplice colonizzazione innocua nelle vie respiratorie o come un’infezione polmonare con eventuale disseminazione i cui sintomi sono quelli della polmonite, della meningite, o del coinvolgimento di pelle, ossa o visceri. Ovviamente la prognosi, un tempo infausta per la progressione dell’infezione, è funzione della diagnosi e della terapia tempestiva.
Dermatofizie o dermatofiti, meglio dermatomicosi: i dermatofiti responsabili (fonte) appartengono agli Ascomiceti (<-) e sono l’Epidermophyton, il Microsporum, ed il Trichophyton spp (specie), muffe che si nutrono della cheratina (dal Gr. κέρας, corno) sclero-proteina complessa filamentosa di amminoacidi ed oligoelementi. Diffusa in tutto il regno animale, nell’uomo la cheratina rappresenta il principale costituente di peli, capelli ed unghie rilevabile nello strato esterno della cute dove i dermatofiti sopravvivono. Questi agenti patogeni sono in grado (fonte) di produrre e secernere cheratinasi, lipasi, proteasi e fosfatasi, che favoriscono la diffusione delle ife in via di sviluppo attraverso lo strato di cheratina che, se intatto, inibisce la penetrazione negli strati più profondi dell’epidermide, almeno inizialmente. Il mannano (già visto in – 3) DIMENSIONI, STRUTTURA e FORME) è una glicoproteina della loro parete cellulare che non solo inibisce la proliferazione dei cheratinociti, ma, soprattutto, inibisce lo sviluppo dell’immunità mediata dai Linfociti T, i primi ad essere impegnati (ragazzi vi ricordo il ruolo dei Linfociti T nei virus, funghi e TBC, nell’embrione e nel favorire la fagocitosi dei L N K). Comunque si ritiene che gli anticorpi umorali non giochino ruoli nell’immunità nei confronti dei dermatofiti.
Le infezioni da dermatofiti vengono a volte chiamate tigna o tinea: le loro infezioni possono presentarsi quasi ovunque sulla cute con eruzioni, desquamazione e prurito. Ecco le espressioni per il sito di comparsa:
cuoio capelluto, tigna o tinea capitis,
barba, tinea barbae,
unghie, tinea unguium o onicomicosi,
corpo, tinea corporis,
inguine, tinea cruris,
piedi (piede d’atleta), tinea pedis.
Questi organismi potrebbero vivere sul nostro corpo senza manifestazione infettiva, ma quando ciò avviene, ci troviamo in situazione di zone ischemiche, come anche nella microangiopatia diabetica (modulo n. 4, lezione n. 18), ovvero in pazienti immunodepressi.
Epidermophyton: Ascomycete -> dermatofizie.
Fusarium: dal Lat. fuso, muffa ambientale, le cui spp causano infezioni superficiali tipo cheratite ed onicomicosi, in pazienti immunocompetenti ed infezioni disseminate in pazienti gravemente immunocompromessi con neutropenia grave prolungata e/o grave immunodeficienza dei Linfociti T. Histoplasmosis capsulatum: fungo dimorfico. Tale passaggio intermittente dalla forma di lievito a quella di ife crea una varietà (pleiomorfismo) antigenica che inibisce, “sconcerta” la risposta immunitaria dell’ospite e questo fenomeno è caratteristico anche della Sporotrix schenkii (->) e del Penicillum marneffei (->). In clinica l’istoplasmosi è un’infezione polmonare primaria derivante dall’inalazione dei conidi, la cui diffusione ai linfonodi ilari e mediastinici (mediastinite fibrosante), milza, fegato, midollo osseo e cervello può essere pericolosa per la vita dei neonati e di altri pazienti immunocompromessi. L’istoplasmosi è caratterizzata dalla crescita del fungo all’interno dei macrofagi con reazione distrettuale, macro- o microscopica da granuloma (ripeto la definizione: neoformazione benigna di natura infiammatoria cronica caratterizzata da un nucleo centrale necrotico, da una corona di macrofagi, neutrofili e linfociti, connettivo e capillari neoformati con una capsula di tessuto sclero-cicatriziale prodotta dai fibroblasti). Da questi nuclei granulomatosi i funghi si possono virulentare, alimentando la loro diffusione in altri siti.
Per inciso questi comportamenti sono sovrapponibili a quelli da Mycobacterium tubercolosis con infezione primaria e riattivazione dallo sviluppo dei bacilli all’interno dei macrofagi. Il tubercolo nella TBC ha un’evoluzione complessa: si parte da essudato che si infiltra negli interstizi alveolo-capillari e sub-pleurici con fenomeni necrotici ed un mix giallastro ricco di bacilli, pastoso simil formaggio, con l’aggettivo appunto di caseoso (necrosi caseosa).
Madurella mycetomatis e M. grisea: dal nome della città di Madurai, India del Sud. Sono ascomiceti filamentosi, nominati nelle micosi sottocutanee (<-).
Malassezia furfur: la forfora è l’espressione di un’intensa desquamazione delle cellule del cuoio capelluto, i cheratinociti, stimolati ad un repentino ed eccessivo ricambio. La Malassezia è un lievito
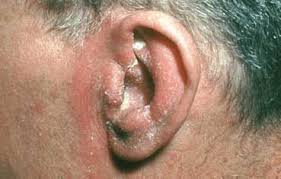
commensale dimorfico, tipico della cute umana che in caso di umidità locali protratte favorisce un’anomala produzione di sebo; ma come opportunista, aspetta i “classici tempi brutti” del Paziente per diventare patogeno, colpisce in genere i lattanti cateterizzati e gli adulti debilitati che ricevono infusioni parenterali con lipidi. (fonte). Come detto, dimorfico, pertanto esiste in due forme morfologiche: uno stato di lievito che una volta era chiamato Pityrosporum ovale e una fase miceliale che è la forma patogena. Ed ecco che localmente abbiamo la Dermatite seborroica e la Pitiriasi o tinea versicolor che si manifesta con chiazze desquamate multiple e asintomatiche con vari colori: bianche, rosa, rosa salmone, marrone chiaro o scuro.
Interessantissime novità su questo fungo “della forfora” forse implicato nel cancro del pancreas (fonte del 4 ottobre 2019).
Micorrize: molte di queste specie appartengono alla famiglia dei Zigomiceti (->), funghi che vivono nel terreno o su materiale organico vegetale o animale in decomposizione.
Microsporon: Ascomycete -> dermatofizie.
Paracoccidioides brasiliensis: è un fungo (fonte) termicamente dimorfico, muffa a 25° C e lievito a 37° C, dall’habitat naturale sconosciuto, le cui infezioni sono state segnalate appunto in Brasile ed in Paesi limitrofi quali reali micosi endemiche e sistemiche dette paracoccidioidomicosi con quadri clinici variabilissimi. La via di ingresso è verosimilmente da inalazione dei conidi con infezione primaria dei polmoni. La forma disseminata coinvolge il sistema reticoloendoteliale (sistema immunitario dei fagociti, diffuso), la cute, le mucose, i linfonodi.
Penicillium o Talaromyces marneffei: è un fungo opportunista e dimorfico patogeno in pazienti del Sud-Est asiatico con AIDS; casi sono stati segnalati in viaggiatori di ritorno dopo visite nella suddetta regione. Le loro lesioni cutanee possono ricordare il mollusco contagioso dei Poxvirus (modulo 20, lezione n. 44, vai a -15) Poxviridae della classificazione).
Pneumocystis carinii o jirovecii, fungo patogeno opportunista nell’uomo sano, nel soggetto immunodepresso diventa marker dell’AIDS di solito con < dei Linfociti T CD4+, evidenziati dall’esame di Lab. già riferito, detto sottopopolazioni linfocitarie ed è molto comune anche tra i pazienti pediatrici affetti da HIV, pur interessando anche i soggetti in terapia cronica con corticosteroidi, i trapiantati ed i portatori di linfomi e leucemie. Il fungo, in tali pazienti presenta un’adesione caratteristica alle cellule ciliate dei bronchi ed a quelle alveolari, proliferando e resistendo all’azione dei macrofagi. Nel parenchima polmonare provoca una polmonite interstiziale (come il Covid-19) con infiltrato caratteristico di plasmacellule e possibile malattia sistemica per disseminazione ematica. Severo è il quadro clinico complesso, mortale in 1 paziente/5.
Scedosporium apiospermum e Sc. prolificans: sono muffe ambientali pressoché ubiquitarie. Le loro spore (fonte) possono essere inalate oppure inoculate attraverso lesioni traumatiche della cute. Nei pazienti con fibrosi cistica, le spore fungine inalate e intrappolate nelle dense secrezioni bronchiali possono germinare e quindi colonizzare il tratto respiratorio; meno frequentemente, le spore possono raggiungere i seni paranasali dando una sinusite. L’incidenza di questa infezione (fonte) è in costante aumento nei pazienti con neutropenia acquisita da TCX o da trapianto di midollo osseo.
Sporotrix shenckii: è un Ascomycete (fonte), muffa saprofita e con dimorfismo: tale passaggio intermittente dalla forma di lievito a quella di ife crea una varietà (pleiomorfismo) antigenica che
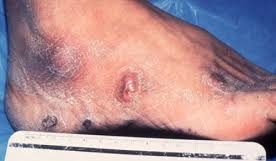
inibisce, “sconcerta” (verbo più volte impiegato, che mi piace perchè esplicito) la risposta immunitaria dell’ospite e questo fenomeno è caratteristico anche dell’Histoplasma capsulatum e del Penicillum marneffei. Per inoculazione trans-cutanea da puntura di spina di rosa (già detto: la “malattia del gestore di rose“) su zone esposte come mani, braccia, viso e piedi, è da considerarsi tra le malattie professionale di giardinieri ed altro, diventa lievito, provocando l’infezione detta sporotricosi, con comparsa di noduli cutanei indolori che si diffondono per via linfatica “a catena di rosario” ed evolvono in ascessi e ulcere con possibile sovrapposizione batterica, espressione letale se si va incontro a setticemia con localizzazioni multiple varie ed ovviamente, ormai lo abbiamo imparato, solo nei pazienti con immunodepressione. Raramente le spore depositate sui muschi vengono inalate, potendo infettare bronchi ed alveoli con infiltrati localizzati o con cavità, il più delle volte in pazienti con patologie croniche polmonari preesistenti.
Trichophyton: Ascomycete -> dermatofizie.
Trichosporon spp: sono lieviti (fonte) responsabili di infezioni superficiali come la Piedra bianca (vedi avanti), polmonite allergica e più raramente di infezione invasiva. Negli anni ’80 erano considerate la seconda causa più comune di fungemia nei pazienti con neoplasie ematologiche dopo la candidemia. Ritorno di numerosi casi clinici negli ultimi 10 – 15 anni per nuove resistenze alle già affidabili terapie antifungine. Trichosporon asahii: è il lievito più aggressivo e frequente tra quelli che causano infezioni disseminate talora mortali nei pazienti neutropenici (ricordo che i granulociti neutrofili sono splendidi fagociti!). Trichosporon beigelii: è un lievito che provoca la malattia detta Piedra bianca, un’infezione superficiale della pelle, cuoio capelluto, capelli e peli pubici, recente patogeno opportunistico degli immunodepressi. E’ stato segnalato come agente di infezione disseminata in pazienti ematologici, oncologici o sottoposti a trapianto d’organo solido (vuol dire non midollo o cellule staminali): nella maggior parte dei casi l’infezione era conseguente ad uno stato di profonda neutropenia e quasi tutti i pazienti non ematologici erano in terapia con steroidi. I neonati prematuri e i pazienti ustionati rappresentano altri gruppi di pazienti in cui è stata descritta fungemia da T. beigelii. Si ritiene che la colonizzazione del tratto gastro-intestinale e del CVC rappresentino una potenziale via di penetrazione per questo microrganismo.
Zygomycetes: sono funghi parassiti filamentosi, il cui corpo è il micelio, il classico intreccio di ife, lunghi filamenti cellulari; sopravvivono nella materia organica in decomposizione ed ovviamente nelle cellule degli organismi parassitati, osservandosi, cosa eccezionale, (fonte), il parassitismo con altri funghi dello stesso specie, un cannibalismo micotico! Le forme sistemiche di zigomicosi sono dette anche mucormicosi. Sono infezioni fortunatamente molto rare (fonte) perché la loro prognosi è quasi
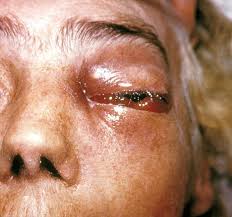
sempre infausta, in parte per la notevole velocità di propagazione di questi microorganismi, ma anche per la loro scarsa o nulla sensibilità ai farmaci antifungini. I principali fattori di rischio per l’insorgenza di zigomicosi si ritrovano, anche qui nei pazienti immunodepressi, aggiungendo però il diabete scompensato come frequenza particolare ed i politrasfusi in terapia chelante con la deferoxamina (contrasta il pericoloso accumulo epatico di ferro).
Nei soggetti normoergici, invece, le infezioni sistemiche da zigomiceti sono sempre conseguenza di una penetrazione traumatica del microrganismo. Sono descritte varie forme di zigomicosi invasiva. Relativamente frequente la forma rinocerebrale che di solito ha origine a livello dei seni paranasali in seguito all’inalazione di sporangiospore. Successivamente queste germinano ed il microrganismo diffonde velocemente interessando la cavità orbitale, il palato e la piramide nasale. In seguito le ife attraversano la lamina cribrosa dell’etmoide e penetrano nell’encefalo, portando il paziente rapidamente a morte. Anche per la Zigomicosi polmonare l’infezione è il risultato dell’inalazione delle sporangiospore e della loro localizzazione a livello dei bronchioli e degli alveoli, con conseguente infarto polmonare e necrosi. La forma gastrointestinale è molto rara, probabilmente secondaria ad ingestione degli elementi fungini, e di solito è associata a grave malnutrizione, soprattutto nei bambini e a malattie gastrointestinali che alterano l’integritàdella mucosa dove si repertano ulcere necrotiche. Ognuna di queste forme può essere fonte di zigomicosi disseminata, a volte con localizzazione cerebrale.
 daddydoctorgym.com il sito dove trovare alcuni consigli per il buon uso della palestra e la donazione di sangue
daddydoctorgym.com il sito dove trovare alcuni consigli per il buon uso della palestra e la donazione di sangue




Un commento
Pingback: Scienze Infermieristiche e Corso OSS Dierreform: programma di Medicina, Dr. Stefano Graziani - daddydoctorgym.com