SCIENZE INFERMIERISTICHE e CORSO OSS.
Modulo 21 lezione 45: FUNGHI o MICETI, CLINICA delle MICOSI.
MICETI patogeni per l’Uomo e per l’ambiente che lo circonda.
Miceti etimologia: dal Gr. mýkēs, funghi.
Funghi etimologia: dal Lat. fungi, funghi.
Organizzazione della lezione:
– 1) COSA SONO I MICETI (FUNGHI)
– 2) AMBIENTE e TROPISMO
– 3) DIMENSIONI, STRUTTURA e FORME
– 4) VIE di INGRESSO
– 5) NUTRIZIONE, FONTI di ENERGIA, RIPRODUZIONE
– 6) VIRULENZA e AZIONE PATOGENA
– 7) MICOSI di INTERESSE CLINICO:
– a) Patogeni primari
– b) Patogeni opportunisti
– c) Micosi superficiali o Tinee
– d) Micosi cutanee
– e) Micosi sottocutanee
– f) Micosi esogene
– g) Micosi sistemiche o profonde, esogene e endogene. Dimorfismo
– h) Genere di Funghi di interesse clinico, in ordine alfabetico.
Dato l’obiettivo della lezione: MICETI patogeni per l’Uomo e per l’ambiente che lo circonda, riferirò molto poco sui funghi che portiamo a tavola!
Anche il capitolo delle terapie lo trascuro, perchè estremamente specialistico e complesso.
– 1) COSA SONO I MICETI (o FUNGHI): 5 sono i regni biologici della natura: degli animali, delle piante, dei miceti, delle monère (sinonimo procarioti e batteri) e dei protisti, gruppo di organismi eucarioti, generalmente unicellulari, autotrofi o eterotrofi, con caratteristiche proprie sia delle piante che degli animali, eterogeneo e polifiletico, cioè senza un comune antenato, non inseribili negli altri 4 regni e senza tessuti altamente specializzati, come le alghe, il fitoplancton e i protozoi. Questi microrganismi si presentano in 3 grandi raggruppamenti (fonte): protisti autotrofi, fotosintetici per la clorofilla, assimilabili alle piante; protisti eterotrofi o protozoi, assimilabili agli animali; protisti saprofiti, che si nutrono per assorbimento, assimilabili ai funghi.
Il regno dei funghi comprende (fonte): funghi, lieviti, muffe o funghi filamentosi, spore,

carboni e ruggini (vedi avanti a – 3).
Il termine micota comprende l’insieme di funghi e muffe, ma è poco impiegato.
Sono organismi eucarioti, quindi provvisti di parete e nucleo, uni- o pluricellulari, aerobi obbligati o facoltativi, eterotrofi, come i batteri, come l’Uomo e tutti gli animali detti metazoi (animali che raggiungono durante lo sviluppo una condizione pluricellulare in grado di esprimere numerose funzioni vitali), si contrappongono ai protozoi che sono organismi unicellulari, ma anche loro eucariotici. Tale regno è un mondo a parte, come visto prima, non sono né piante né animali e ciò per la loro composizione che vedremo avanti e comprende molte decine di migliaia di specie, comprese quelle da tavola, eduli, con oltre 200 specie patogene per l’Uomo, alcune delle quali le vedremo nella – 7) MICOSI di INTERESSE CLINICO.
Il loro ruolo nell’arricchimento del terreno avviene attraverso la partecipazione fungina alla formazione dell’humus (dal Lat. humus, suolo, terra, terreno), complesso colloidale e pertanto molto assorbente di sostanze prevalentemente organiche, fondamentale per la nutrizione delle piante, formatosi dalla decomposizione di residui animali e vegetali con il contributo di altre molecole sintetizzate da varî altri organismi che vi vivono.
Per quanto riguarda il risanamento ambientale i funghi sono importanti agenti di decomposizione capaci di demolire, degradare molti composti organici come la cellulosa e la lignina, presente nelle cellule vegetali, generando sottoprodotti chimici semplici ed inorganici smaltendo l’accumulo di carbone e risanando falde acquifere e terreni inquinati (-> inquinamento e malattie) da metalli pesanti ed idrocarburi ed inoltre alcune specie sono impiegate per la produzione di molecole antibiotiche e pertanto ricordo il primo antibiotico prodotto che fu la penicillina, derivata dal Penicillium funghi nel 1929 ad opera del Medico USA Alexander Fleming (1881 – 1955), di bevande, alcool ed enzimi.
Promettenti gli studi sul fungo Shiitake (fonte) (che trovo al supermarket disidratato in bustine) dal quale si estrae l’alfa-glucano, un composto attivo a 6 atomi di carbonio associato ad una miscela di aminoacidi, polisaccaridi e minerali che presenta un particolare valore nutrizionale e metabolico dei globuli bianchi, esaltando l’attività immunocmpetente, divenendo così un importante supporto nel trattamento di varie patologie fra le quali il frenare la crescita del cancro della cervice uterina ad opera dell’HPV (-> HPV nel modulo n. 20, lezione n. 44).
Restando nell’argomento, in campo industriale (fonte) si studiano alcuni tipi fungini per ottenere carburante per le auto (Dipartimento dell’energia USA); dai lieviti si ricava il bioetanolo per certi tipi di motori, da altri, digerita la cellulosa, si ottengono sottoprodotti degli idrocarburi. Ed ancora in Italia tali microrganismi sono stati utilizzati anche per ossigenare le acque del lago bergamasco di Endine (Bg), rendendolo balneabile e pescoso; le spore di un particolare fungo, il Metarhizium anisopliae sono servite per formulare un bioinsetticida che stermina le cavallette giganti responsabili della distruzione di molte coltivazioni in Africa. Dalle muffe l’acido citrico, risparmiando gli agrumi con costi contenuti. Vai a ruggini per il loro impiego industriale.
– 2) AMBIENTE e TROPISMO: i funghi vivono ovunque, cioè ubiquitari e rispettando comunque le singole ed abituali stagioni di crescita li troviamo abitualmente nei boschi, parassiti di piante, di animali e di altri funghi (!), nei terreni, negli oceani, nelle acque costiere, sulle dune sabbiose con gli psammofili (ammos in Gr. sabbia), in pianura e ad altitudini fino a 2.500 m. s.l.m.. Altri sono saprobi o meglio saprofiti (dal Gr. sapros, putrido, marcio e bio, vita e phyton, pianta) vivono cioè decomponendo materia organica inerte, morta, contribuendo così al fenomeno della degradazione, scomponimento dei complessi organici. La maggior parte dei generi si trova in aree geografiche ben definite, verosimilmente in rapporto alla presenza dei mammiferi preferiti da infettare.
Per quanto riguarda il tropismo, si afferma che non esiste e tale concetto si può assimilare in modo un po’ anomalo, alla crescita periferica delle ife che cercano l’ambiente più favorevole, come le radici del mondo vegetale. I miceti non hanno movimento poichè sprovvisti di elementi dedicati al moto attivo.
– 3) DIMENSIONI, STRUTTURA e FORME:
Dimensioni: macromiceti: funghi mangerecci e funghi velenosi. Micromiceti: le forme microscopiche, da quelle di una singola cellula, circa, tra i 2 e i 40 micron, come per i lieviti (fonte),
a quelle delle spore (fonte) che variano dai 3 μm di Aspergillus e Penicillum, fino ad oltre 150 μm di Helminthosporium.
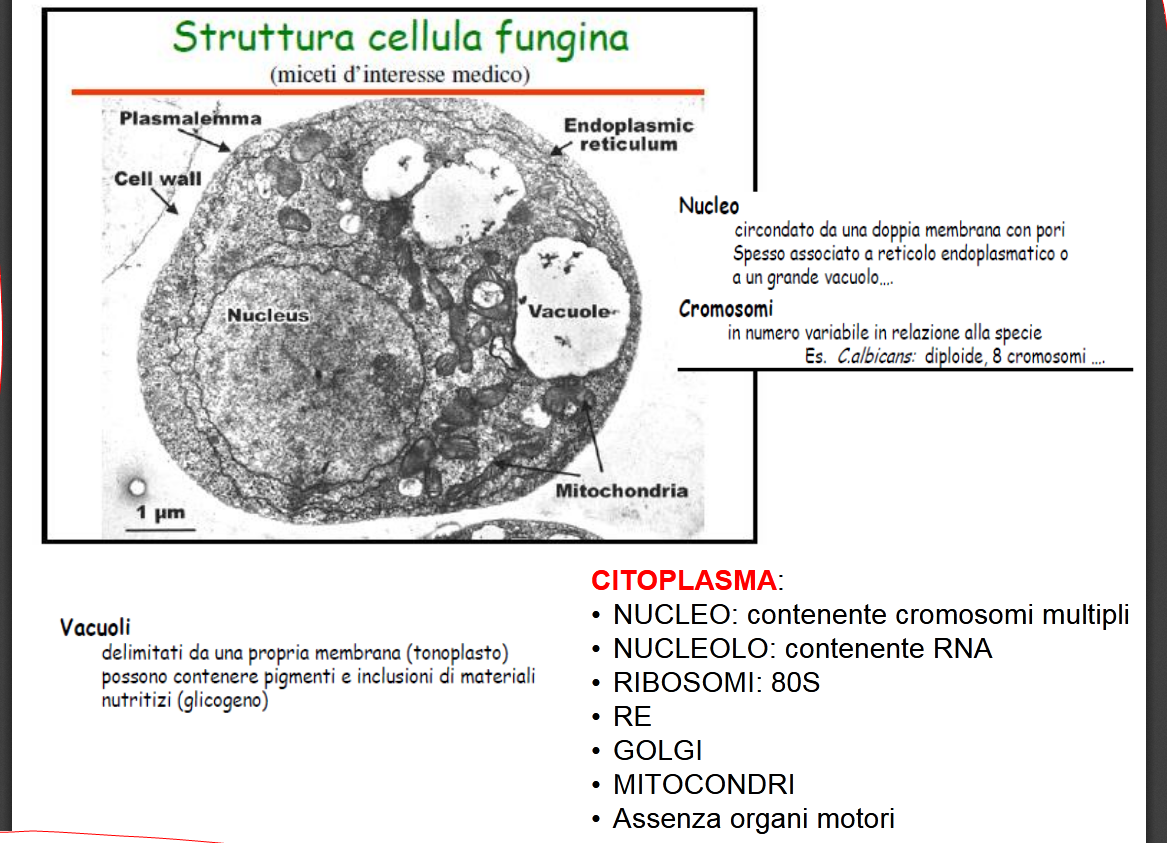
Strutture e forme: abbiamo detto all’inizio che i miceti comprendono funghi, lieviti, muffe, spore, carboni e ruggini. Come eucarioti, sono quindi provvisti di parete esterna o tunica, un esoscheletro regolatore della forma del fungo e del passaggio dell’acqua con proprietà antigeniche, compatto, rigido, pluristratificato e complesso costituito da numerosi polisaccaridi polimeri denominati β-glucani e chitina, polimero di un aminozucchero presente anche nell’esoscheletro degli artropodi (insetti, ragni, crostacei, vermi millepiedi) ma assente nelle piante (!),che risulta essere molto resistente alla fagocitosi ed alle molecole antimicotiche ed infine i mannani, polisaccaridi polimeri del mannosio, che si complessano con le proteine, contribuendo alla rigidità della parete e svolgendo funzioni fondamentali come quella antigenica e quella della adesione (vedi- 6) VIRULENZA e AZIONE PATOGENA ) alla cellula ospite.
Esternamente alla parete, e solo per il Cryptococcus neoformans (->), può esserci una
capsula di natura muco-polisaccaridica, più o meno spessa che rappresenta (fonte) un fattore di virulenza specialmente per i lieviti con valenza antigenica ed effetto pirogeno e tossico (vedi ancora -6).
Abbiamo quindi il
plasmalemma o membrana citoplasmatica formata da glicoproteine, fosfolipidi ed ergosterolo, steroide sul quale agiscono maggiormente gli antimicotici, il
citoplasma con nucleoli di glicogeno e di RNA, mitocondri, ribosomi per la lettura dell’RNA per la sintesi proteica, la
membrana nucleare a doppio strato poroso ed il
nucleo con DNA: il numero dei cromosomi varia a seconda della specie fungina. Ripeto l’assenza di elementi esterni per la movimentazione.
I funghi, tranne i lieviti monocellulari, generano con crescita vegetativa alle loro estremità un complesso di ife detto conidi, strutture pluricellulari, filamentose e tubulariforme dalle dimensioni di 2 – 10 µm (1 µm ricordo è un millesimo di millimetro incontrato nella lezione sui batteri) corredate di mitocondri e glicogeno (polimero di glucosio) che formano il loro corpo vegetativo o micelio. Gruppi o compartimenti di ife possono essere raggruppate da pareti dette setti anche loro ricche di chitina, come la parete. Attraverso le ife, muffe e funghi in generale assorbono le sostanze nutritive. Appartengono a questo gruppo i lieviti, funghi commestibili, tartufi ed alcune specie marine. Vedi avanti altre caratteristiche.
Vediamoli in modo sintetico.
LIEVITI: organismi unicellulari di forma ovoidale o sferica, necessitano dell’aria, ma anche la sua assenza ha conseguenze sul loro sviluppo che vedremo più avanti (la fermentazione), per moltiplicarsi in maniera asessuata con la mitosi cioè la divisione cellulare o gemmazione per garantire l’unicità della
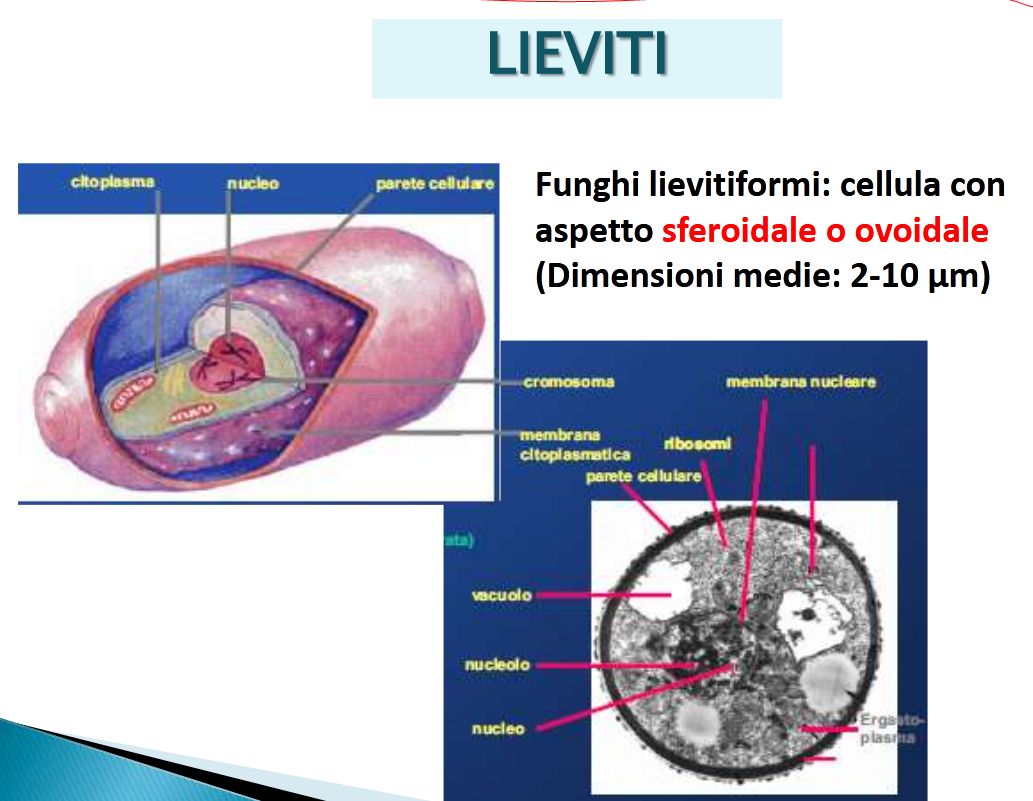
generazione (fonte) raramente per via sessuata con due genomi e quindi generazioni diverse.
La forma parassitaria tissutale dei lieviti si esprime alla temperatura anbientale di 37 °C. La diffusione dei lieviti negli organi e tessuti sembra essere favorita addirittura dalla fagocitosi dei monociti -> macrofagi, perchè in essi non sono digeriti, si sviluppano e si espandono con la morte degli ospiti.
La composizione di una cellula di lievito comprende una parete costituita da proteine, dai polisaccaridi beta-glucani (ricordo che l’alfa-glucano lo troviamo nel prezioso fungo shiitake, prima segnalato) e dalla chitina, amminozucchero simil cellulosa vista poco prima, una robusta e compatta membrana citoplasmatica ad alto contenuto di complessi proteici e chitina ed il nucleo che presenta 16 cromosomi.
Il lievito più noto è quello di birra o per panificazione o Saccharomyces Cerevisiae (dal Lat. saccharo, zucchero e myces, fungo e cerevisiae dal Gaelico-Celtico kerevigia, produzione di birra), presente anche sulla buccia dell’uva, impiegato in modo versatile nei campi sanitario-farmaceutico umano e veterinario per la produzione di penicilline e cefalosporine, alimentare ed aromatizzazioni varie e cosmetico.
In assenza di aria, anaerobiosi, vediamo la fermentazione alcolica con la produzione di alcol etilico o etanolo (C2H5OH) per panificazione e produzione di birra, della salsa di soia, formaggi vari, vino di riso o saké (bevanda alcolica giapponese dalla fermentazione di acqua, riso o orzo e spore koji dell’aspergillus oryzae) e vino: qui il mosto (prodotto della pigiatura o torchiatura degli acini dell’uva) diventa vino; per la birra: il malto, che è il chicco ripulito di un cereale, orzo di solito o mais che ha germinato e che viene messo in una complessa lavorazione in acqua ben aerata e a temperature precise con successive fasi. Per la panificazione: lo zucchero viene trasformato principalmente in CO2, che determina l’espansione dell’impasto ed etanolo che evapora durante la cottura. In questo fenomeno, il lievito sviluppa poco energia, bene per vivere, ma insufficiente per la riproduzione. Invece in aerobiosi i lieviti respirano (assumono O2) e si moltiplicano abbondantemente ovviamente senza produzione di alcol. Lo zucchero di cui si nutrono è trasformato in anidride carbonica e acqua con il noto fenomeno della glicolisi aerobica (che io chiamo “formula della vita”, modulo n. 3, lezione n. 11) ed ampia produzione di ATP, l’energia vitale!
MUFFE o FUNGHI FILAMENTOSI o IFOMICETI: sono (fonte) organismi pluricellulari, agglomerati di ife (dal Gr. hyphé, tessuto), elementi strutturali filamentosi intrecciati “a rete” che rappresentano il loro corpo vegetativo, il micelio o tallo, dai quali prende l’aspetto ed i colori che
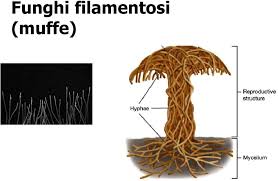
variano a seconda delle spore e delle condizioni ambientali favorevoli, come interni trascurati, caldi, umidi non aerati e senza luce solare.
SPORE: già nominate nelle muffe, sono piccolissime cellule disidratate, caratterizzate da una formidabile resistenza alle avversità ambientali. Nascono dalle ife, loro apparato vegetativo prendendo il nome di conidi, già detto, si liberano dalle colonie nell’ambiente favorevole e si disperdono nell’aria con i venti e le correnti per poi depositarsi praticamente ovunque, ma con sviluppo del tipo fungino nell’ambiente ideale per ogni tipo di spora (vedi -2, AMBIENTE).
Le spore allo stato vegetativo si definiscono conidi (dal Gr. kònis, polvere e dal suffisso diminutivo idion, piccolo, cioè polverina), struttura riproduttiva asessuata. Oltre a potersi tramutare in lieviti, le muffe nei confronti dell’Uomo hanno un potenziale patogeno allergico, con produzione quindi di anticorpi IgE, (vedi -6, virulenza) o tossico; la forma saprofitica predilige i 25 °C ambientali.
La sporogenesi è la loro modalità di riproduzione: esse si formano per agglomerati di microscopiche spore estremamente resistenti in sospensione nell’aria. Una volta che si depositano negli ambienti favorevoli suddetti, ma anche alimenti, mobili, libri indumenti ecc., le spore germinano e velocemente si riproducono, riconoscendole prima per la comparsa delle ife come minimi puntini colorati o neri e quindi come vere macchie scure “a mollica di pane” o “spugnose” che sono gli agglomerati di miceli. Le muffe sono responsabili della produzione di micotossine (vai a -6) VIRULENZA).
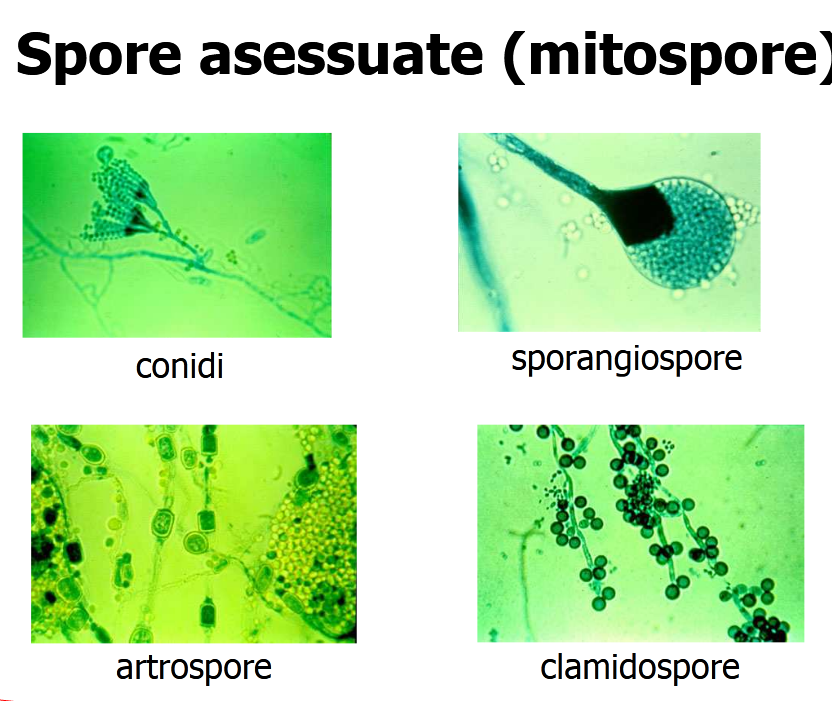
CARBONI: parassiti delle piante, caratterizzata dalla formazione di una massa nera, dovuta ai funghi Ustilaginali che attaccano aglio, cipolla e cereali con danni produttivi anche severi. Si organizzano in una massa nera compatta o cipriosa composta da milioni di spore scure.
RUGGINI: sono funghi (fonte) basidiomiceti, anche loro parassiti di pini, abeti, cedri, larici, pioppi, querce ed altri, ma anche rose, orchidee, crisantemi dalie, fiordalisi ecc. Non sono patogeni, e vengono impiegati (fonte) sia a livello industriale, principalmente nell’industria della carta, sia a livello ambientale, nei processi di biorisanamento.
Una precisazione: esistono numerosi esempi di dimorfismo fungino che è la capacità di alcune specie (fonte) di modificare reversibilmente la loro espressione morfologica, passando dalla forma filamentosa (muffa) a quella unicellulare (lievito) in base a variazioni ambientali, soprattutto termiche. Esempio delle muffe -> lieviti a 37°C e lieviti -> muffe a 25°C: tale passaggio intermittente dalla forma di lievito a quella di ife crea una varietà (pleiomorfismo) antigenica che inibisce, “sconcerta” la risposta immunitaria dell’ospite e questo fenomeno è caratteristico della Candida spp., dell’Histoplasma capsulatum, del Penicillum marneffei e della Sporotrix schenkii (per questi 4, ->- 7) MICOSI di INTERESSE CLINICO: – h).
– 4) VIE di INGRESSO: per un fungo la capacità di parassitare un essere umano SANO è relativamente raro, non per piante, animali e alghe. Queste le vie di ingresso.
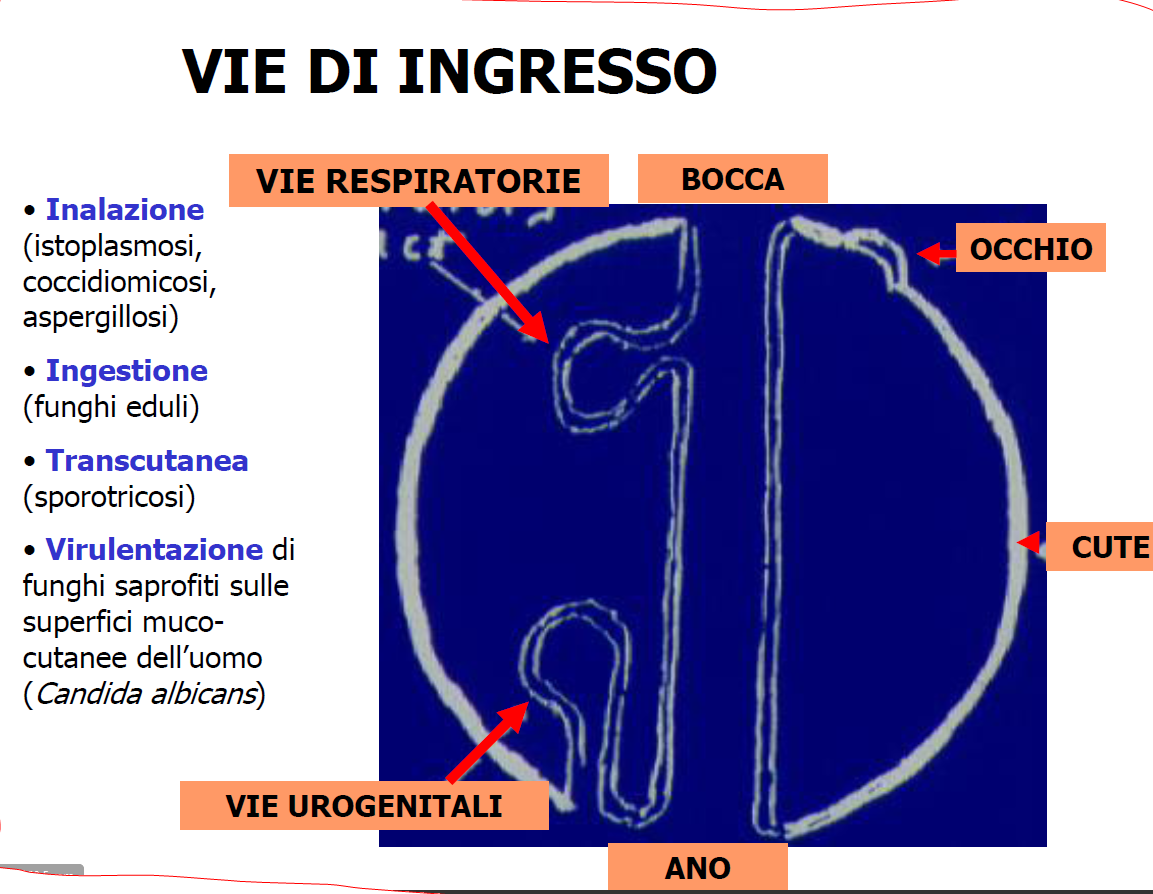
– 5) NUTRIZIONE, FONTI di ENERGIA, RIPRODUZIONE: come visto in -3), muffe e funghi in generale assorbono le sostanze nutritive attraverso le ife con varie proprietà (fonte), tutte finalizzate al proprio nutrimento con l’assorbimento post-lisi enzimatica ad opera di molecole da loro sintetizzate, chiamate enzimi digestivi, impiegati per degradare la materia organica così assimilabile. E allora, come si organizzano i miceti per reperire cibo e quindi Energia? Ciò avviene attraverso 3 vie: come
saprofiti, già visto, come;
commensali: traggono beneficio dall’organismo con cui vivono in stretto contatto, senza danneggiarlo;
parassiti scegliendo animali, piante e persino altri funghi (cannibalismo) vivendo adesi o al loro
interno, danneggiandoli;
simbionti o per simbiosi: vivono insieme ad altri organismi, traendone vantaggi. Alcune specie hanno sviluppato complesse “convivenze” con organismi fotosintetici, come accade nelle micorrizie (simbiosi micelio di un fungo con le radici o i rizomi, cioè fusti perenni, di alcune piante erbacee o arboree) o nei licheni (simbiosi di funghi ed alghe).
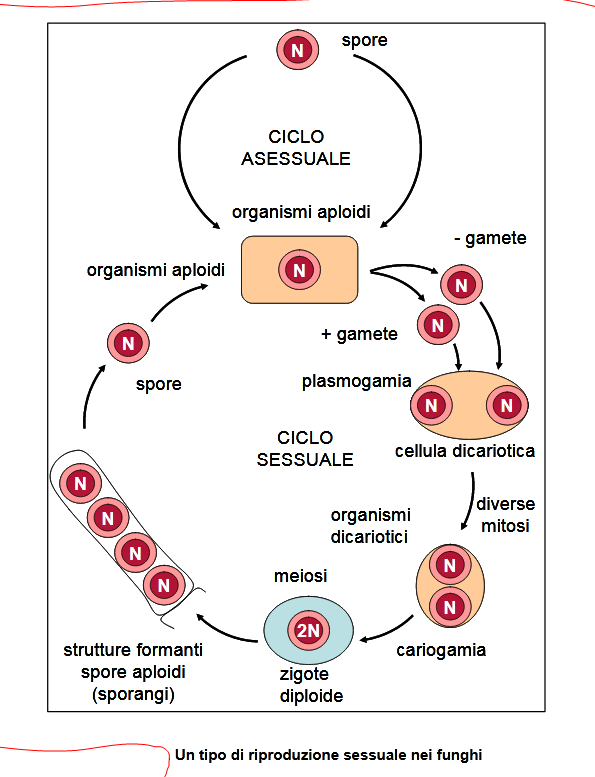
Così, trovata la fonte energetica (fonte) i miceti si riproducono in maniera sovrapponibile a quella delle piante e dei batteri anaerobi, cioè tramite le spore.
Il fenomeno avviene pertanto in maniera sessuata, attraverso la fusione di due o più nuclei come avviene per i funghi superiori, macroscopici, o in modalità asessuata o vegetativa, la più frequente, attraverso la germinazione (o germogliazione) della cellula madre che produce una cellula figlia più piccola, che si accresce e sviluppa dalle spore dette mitospore o endospore (dal Gr. éndon, dentro, interno e sporà, seme, origine), producendo poi l’insieme di ife, il micelio.
Le riserve energetiche sono rappresentate dai polisaccaridi (fonte) che i funghi possono accumulare, analogamente agli animali, sotto forma di glicogeno (polimero di glucosio), diversamente dai vegetali che utilizzano l’amido, il C6H10O5 con n, polimero.
– 6) VIRULENZA e AZIONE PATOGENA. La maggior parte delle specie fungine (fonte) che causano patologie nell’uomo proviene da sorgenti esogene, ambientali. Solo le specie di Candida appartengono alla microflora umana, dove il fungo può rimanere anche per molto tempo inattivo, oppure può moltiplicarsi senza fare danno: è il fenomeno della colonizzazione.
Tra milioni di specie fungine poche soddisfano le 7 condizioni di base necessarie, i fattori di virulenza, per infettare o intossicare l’uomo.
1) tolleranza alle temperature corporee o termotolleranza: da -5°C a 60°C, ma per quelle di interesse clinico va da 22 a 37,5°C circa, con il massimo nelle Candide e nell’Aspergillus fumigatus, che prosperano anche a temperature corporee di 39 – 40 °C.;
2) adesione o adesività: è un fenomeno multifattoriale, meccanismo fondamentale nell’attività dei miceti opportunisti. Può avvenire secondo due modalità fondamentali (fonte), aspecifica con cariche elettriche di superficie, e specifica dei recettori cellulari dell’ospite con le mannoproteine delle adesine, specifiche molecole di adesione (fonte) che rappresentano veri e propri fattori di virulenza correlati alle strategie da tropismo biochimico, non esistendo una possibilità di locomozione fungina, come per i virus, presente invece nei batteri. Fondamentalmente tali molecole si legano chimicamente con un fosfolipide complesso alla parete cellulare e vengono in essa incorporate. Questo “attacco” nel vero senso della parola consente la successiva invasione grazie all’ifa che si ancora alla cellula ospite, esercitando una pressione penetrante favorita dal turgore della sua punta e, penetrata, è in grado di rimanere in quel luogo;
3) capacità di invadere l’ospite umano (infezione): avviene ad opera dei propaguli, agenti infettivi del micelio, spore con i conidi (dal Gr. kònis, polvere), o mitospore (da mitosi) presenti all’estremità delle ife con i fenomeni della inoculazione e penetrazione che consente l’ingresso. Questo avviene per due vie: attraverso la cute come le ife soprattutto dei lieviti con le loro estremità compatte e appuntite nell’Uomo e negli animali e per via aerea (droplets, tanto nominate in epoca di Covid-19) con minuscoli propaguli rotondi. Dopo l’ingresso può seguire o meno la fase della colonizzazione distrettuale (loco-regionale) e della disseminazione sistemica per via ematica o linfatica dopo un congruo periodo di incubazione;
4) capacità di sopravvivere e permanere negli organi e nei fagociti (che ricordo essere i granulociti neutrofili ed i monociti dalla linea rossa o mieloide del midollo rosso ed i linfociti Natural Killer dalla linea linfoide, provenienti dai linfociti B attivati): grazie al dimorfismo muffa-> lieviti -> muffe, si può quindi esprimere la patogenicità in condizioni ambientali a loro favorevoli e versatili! Anche le dimensioni relative hanno la loro valenza di virulenza, in quanto le maggiori dimensioni dei miceli li preservano dalla fagocitosi (argomento che metterò anche nelle risposte immunitarie, più avanti), mentre nella fase di lievito alcuni miceti sono in grado di sopravvivere all’interno dei granulociti neutrofili, che hanno un diametro di circa 10- 20 μm (micron, un millesimo di mm.). Questo inserimento cellulare può rappresentare un mezzo per la diffusione di un’infezione. Il dimorfismo porta anche ad un polimorfismo antigenico come avviene per la Candida albicans nel suo tubulo germinativo delle ife che può essere in grado di “stupire, imbrogliare” e quindi invalidare l’eventuale risposta immunitaria precedente.
Le specie con dimorfismo più influenti clinicamente (per le caratteristiche vai a – h), genere (e specie) di funghi di interesse clinico): Coccydioides immitis, Histoplasma capsulatum, Blastomyces dermatitidis, Paracoccidioides brasiliensis, Paracoccidioides marneffei e Sporothrix schenckii e alcuni funghi opportunistici come Candida albicans e Penicillium marneffei.
5) digerire per lisi enzimatica e assimilare gli elementi biochimici dei tessuti umani (o di altri ospiti) è fondamentale: l’ospite (o vittima!) è la fonte, il substrato dal punto di vista nutrizionale con particolare riguardo al ferro (fonte), necessario sia alla respirazione (elaborazione con l’O2 come per gli animali) fungina che nei processi enzimatici critici.
Ricordo 7 + 1 enzimi ad azione dannosa sulla membrana cellulare dell’ospite: cheratinasi, proteinasi, elastasi, collagenasi, serin-proteasi (del Paracoccidioides brasiliensis, -> Clinica), lipasi e fosfolipasi e l’8°, le reduttasi che agiscono sui legami disulfurici provocando la denaturazione delle proteine. Il passo successivo è quello di assorbire le molecole provenienti dalla digestione dei tessuti ospiti. Queste abilità biochimiche sono i reali mediatori dell’invasività micotica, organizzatissima, perchè si esplica anche con le funzioni di gestione degli oligoelementi (micronutrienti), del trasporto di azoto, delle fonti di carbonio per i peptidi e quindi enzimi, nonché ioni metallici per i gradienti elettrici.
Per i macrofunghi, versante positivo nutrizionale, sottolineo la capacità di sintetizzare la lisina, amminoacido essenziale per l’uomo ed il triptofano; contengono carboidrati e proteine di tipo vegetale, vitamine del gruppo B, folati, selenio e sali minerali; sono inoltre una fonte di sostanze antiossidanti utili per la risposta immunitaria, ricordo i funghi Shiitake, per la prevenzione dell’invecchiamento (aging) e per i danni causati al nostro organismo dai radicali liberi con lo stress ossidativo;
6) resistenza al sistema immunitario; induzione di allergie (ipersensibilità immunitaria o atopia). Qui, già detto, l’invasione fungina è rara nei soggetti sani mentre predilige pazienti con immunodepressione, come già li abbiamo più volte enumerati. (Vai avanti a patogeni primari per l’elenco che ho fatto, credo abbastanza preciso. Accetto ben volentieri consigli) nei quali le terapie causali risultano essere estremamente complesse e dai risultati non sempre soddisfacenti in quanto l’elemento “fagocitosi” viene ad essere debole o praticamente assente, sia per la consistenza della capsula di polisaccaridi, presente in realtà solo nel perfido Cryptococcus neoformans, che per la debolezza dell’attivazione dei linfociti T per il comando ai linfociti B per la produzione di anticorpi da parte delle plasmacellule. (Al riguardo vi ricordo la lezione n. 5 del modulo n. 2 sul SANGUE).
Esempio classico al riguardo è l’Aspergillus fumigatus, che oltre a produrre un’aflatossina, con la sua gliotossina (fonte) esercita attività antimicrobica e immunodepressiva per induzione dell’apoptosi (dal Gr. ἀπό, apo, da e πτῶσις, ptosi, caduta, è la morte programmata, naturale delle cellule, ma qui si induce il “suicidio“) dei fagociti.
Altro fattore, quello dimensionale, che è elevato per i conidi che impediscono alle ciglia dell’epitelio respiratorio di bloccarli, immergerli nel muco ed eliminarli con la tosse.
Con la Candida albicans abbiamo altre caratteristiche al riguardo: adesione e formazione di biofilm (come avviene anche con i batteri e non con i virus), da parte delle ife che aumenta la resistenza all’attività immunitaria ed alle molecole antifungine, che promuove la colonizzazione distrettuale quando si frammenta con l’espressione di fattori di virulenza enzimatici e ionici. Il biofilm (fonte) è un mix extracellulare di polisaccaridi che come una pellicola riveste colonie di microrganismi, qui funghi. Le sue funzioni sono quelle di trattenere acqua e nutrienti, di proteggere dalle attività immunitarie e dai cambiamenti dei parametri ambientali, garantendo così un’omeostasi.
Ed ancora un altro esempio: con il Criptococcus neoformans si ha inibizione della migrazione leucocitaria e della fagocitosi.
Ipersensibilità: si hanno reazioni allergiche (fonte) ad antigeni delle spore e muffe clinicamente evidenziabili con polmonite da ipersensibilità (iperattività non fisiologica, detta anche atopia) con rinite, asma e alveolite.
7) produzione di micotossine e loro ingestione: le micotossicosi. Un po’ fuori tema, ma…
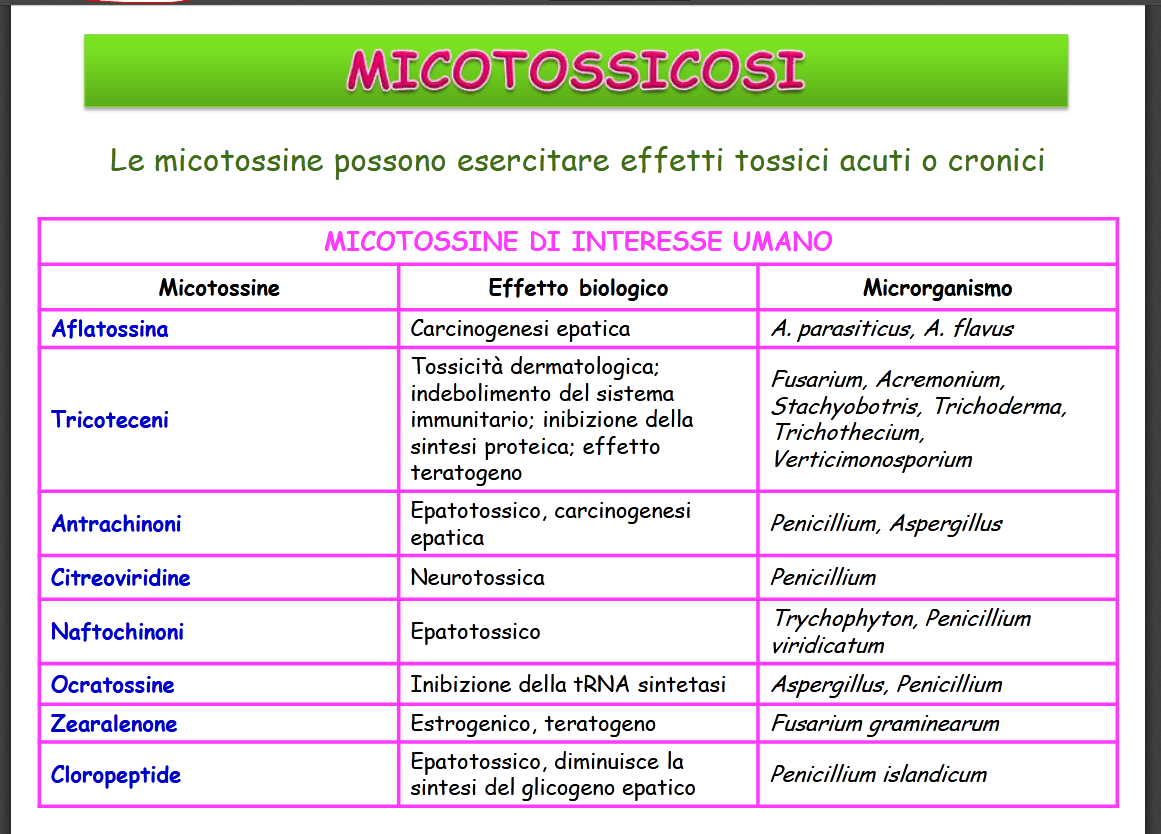
Tali tossine sono prodotte dalle muffe come metaboliti secondari in determinate condizioni ambientali non igieniche. Il termine micetismo indica l’avvelenamento da funghi velenosi, la micotossicosi è l’avvelenamento da prodotti alimentari contaminati dalle suddette molecole alcune delle quali hanno anche effetti mutageni, cancerogeni e teratogeni.
Le aflatossine, intuite dalla seconda metà dell’800, sono state ben studiate dal 1960, sono sicuramente le più frequenti cause di questi eventi dovuti all’Aspergillus flavus, Asp. parasiticus, Fusarium sporotrichioides e Fus. poae. Stesso agente per la malattia X del tacchino del 1994 con centinaia di migliaia di gallinacei morti. Uno degli esempi meglio documentati di micotossicosi umana (fonte) risale agli anni ’40, nel distretto di Oremberg in Russia, dove fu descritta l’insorgenza di una tossicosi alimentare correlata all’ingestione di cereali colonizzati dai due Fusarium suddetti.
Altri metaboliti implicati, più conosciuti: alcaloidi dell’ergotamina che provocano l’avvelenamento detto ergotismo con blocco alfa-adrenergico che clinicamente si appalesa con vasocostrizione periferica protratta, ischemia, necrosi e sua infezione, la gangrena: è la segale cornuta, malattia dovuta al parassita Claviceps purpurea che attacca i fiori delle graminacee appunto segale, orzo e frumento. Psilocina dalla psilocibina, agente psicotropo, triptamina psichedelica presente in alcuni funghi allucinogeni tipo psilocybe e stropharia. Da qui l’LSD, la dietilamide dell’acido lisergico.
Discorso fuori tema è l’avvelenamento da Amanita phalloides (dal Gr. amanìtés, fungo del monte Amano, nella Turchia orientale e phallòs, fallo e eìdos, forma, sembianza, a forma di fallo) con le sue tossine mortali amantine alfa e beta, causa di epatite acuta (necrosi dell’epatocita) fulminante e le falloidine, anche loro epatocitolesive e responsabili di gastroeneterite acuta con insufficienza renale acuta drammatica.
– 7) MICOSI di INTERESSE CLINICO.
Una sistematica e didattica esposizione dell’argomento è estremamente difficile, perchè complesso e “ramificato”, come le ife fungine!
Ciò mi ha richiesto molto tempo, ma poi, eccomi qua, sperando di esserci riuscito. Quindi l’aggettivo “clinico” ci porta alle problematiche umane ed all’ambiente che partecipa e condiziona le manifestazioni patologiche.
Organizzazione dell’argomento. Voci:
– a) Patogeni primari
– b) Patogeni opportunisti
– c) Micosi superficiali o Tinee
– d) Micosi cutanee
– e) Micosi sottocutanee
– f) Micosi esogene
– g) Micosi sistemiche o profonde, esogene o endogene. Dimorfismo
– h) Generi di Funghi di interesse clinico: in ordine alfabetico.
Le specie di seguito nominate sono sinteticamente descritte in ordine alfabetico alla fine di questo articolo.
Le infezioni micotiche NON sono contagiose, tranne le dermatofizie e le candidosi.
– a) PATOGENI PRIMARI: possono determinare sempre infezioni, sia nell’ospite sano, tanto più nel Paziente immunodepresso e di solito hanno ben definite aree geografiche di azione. Sono: Blastomycosis dermatitidis, Coccidioides immitis e C. posadasii, Criptococco neoformans, Histoplasmosis capsulatum, Paracoccidioides brasiliensis (->). Nel Madagascar, le cromoblastomicosi (-> micosi sottocutanee)
![]()
E’ questo allora il momento di fare un elenco delle categorie dei Pazienti immunodepressi o a rischio di immunodepressione, già descritto nel modulo n. 2, lezione n. 5 sul SANGUE che qui riporto e che vi prego (sarebbe meglio dirvi OBBLIGO!) di ricordare:
le immunodeficienze neonatali e le malattie autoimmuni gravi acquisite, come i Pazienti con AIDS, gli Oncologici soprattutto se sotto chemioterapia (TCX, chemioterapia antiblastica) o in Radioterapia estesa ed i trapiantati soprattutto con cellule staminali a causa delle terapie immuno-soppressive, nelle leucemie e linfomi, i politrasfusi, i soggetti in stress (stress compagno di vita) acuto e cronico, (modulo n. 17, lezione n. 41 sul Sistema psico-neuro-immuno-endocrino), gli anziani avanzati in scarse condizioni igieniche, deficit ormonali,
quelli con MOF (Multi Organ Failure o sindrome da deficit multiorgano), i politraumatizzati, i Pazienti di Chirurgia avanzata ampiamente demolitiva e ricostruttiva, alcolisti cronici e malnutriti anche e spesso in Ospedale (!) quale patologia iatrogena (modulo n. 6, lezione n. 22). I cateteri venosi centrali (CVC) e gli stent biliari, endocoledocici a permanenza o presenti per tempi molto prolungati possono essere elementi favorenti le infezioni sistemiche, valutando anche la diagnosi e l’eventuale fragilità del paziente (le famose condizioni cliniche preesistenti), molto meno gli altri presidi come il C.V., gli stent ureterali, uretero-pielici, drenaggi biliari o trans-epatici esterni, drenaggi liquor cerebrale-peritoneo ed infine tubi per alimentazione enterale artificiale gastro-digiunali.
![]()
– b) PATOGENI OPPORTUNISTI: in condizioni fisiologiche di salute, e già riferito, si hanno alti livelli di resistenza alle infezioni fungine che sono invece frequenti solo quando l’ospite è nelle suddette situazioni immunitarie patologiche. Voglio ricordare che i funghi definiti opportunisti fanno parte della normale componente microbica dell’organismo come endosaprobi (che vivono all’interno) e commensali (mangiano insieme!), ugualmente alla componente batterica del nostro microbioma (modulo n. 11, lezione n. 30), ma se, come spesso riferito (!), il Paziente si trova in deficit immunitario severo si ha il passaggio dalla fase di commensalismo a quella di parassitismo patogeno. Ecco gli opportunisti più importanti: Aspergillus fumigatus, Candida albicans, Cryptococcus neoformans, Fusarium, Penicillium marneffei, Pneumocystis jirovecii, Trichosporon beigelii, Zygomycetes (tutti ->).
– c) MICOSI SUPERFICIALI: sono infezioni presenti principalmente ai Tropici, limitate all’epidermide, lo strato esterno della cute, ai capelli, peli ed alle unghie con nulla o scarsissima reazione immunitaria da parte dell’ospite. I funghi interessati: il Malassezia furfur (anche viscerale pancreatica (vedi -> SPECIE) e varie spp di Ascomyceti (->).
d) MICOSI CUTANEE o TINEE (o TIGNE): parliamo delle dermatofitosi (dal Gr. δέρμα, derma, pelle e phytón, pianta), ma sappiamo bene che il mondo vegetale “è un altro mondo” o regno a parte, quindi storicamente è un termine inappropriato, meglio la dizione di dermatomicosi. Tali dermopatie sono determinate da funghi appartenenti a 4 generi detti dermatofiti patogeni per l’Uomo e per gli
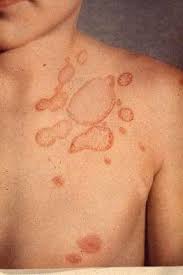
animali: Epidermophyton, Lophophyton, Microsporum e Trichophyton (anticipo la frequente Tinea capitis), generi definiti anche cheratinofilici (dal Gr., che amano la cheratina) il cui habitat è il suolo dove elaborano cellule della cute e peli animali ed umani eliminati, esfoliati e depositati nell’ambiente. La loro patogenicità si esplica invece crescendo e degradando la cheratina delle cellule epiteliali dello strato corneo della cute, dei capelli, peli, unghie o artigli di persone e animali viventi. Essi si comportano quindi come saprotrofi o saprofiti non invasivi, ma la loro crescita provoca irritazione e infiammazione delle cellule epiteliali sottostanti espressione di una reazione allergica (quindi con produzione di anticorpi, diversamente dalle intolleranze) che può causare la morte di queste cellule. Clinicamente avremo pertanto le classiche croste, desquamazioni e alopecia (dal Gr. ἀλωπεκία, volpe, che perde il pelo a chiazze).
– e) MICOSI SOTTOCUTANEE: la via di ingresso è da lesioni cutanee, anche minime.
Sono un gruppo di complesse e svariate infezioni del derma, sottocute, muscoli, fasce aponeurotiche e non di rado, nelle forme avanzate, anche delle strutture ossee, che possono pertanto diffondersi localmente per contiguità ed anche per via linfatica o addirittura per via sistemica, dovute a funghi saprotrofici del terreno, abituali delle regioni tropicali e subtropicali del Sud America, specialmente Perù, poi Indonesia, India ed Africa. Intuitivo dire che la maggior parte delle persone coinvolte cammini a piedi nudi o che ci si possa ferire alle mani o braccia, anche in modo lieve, apparentemente “innocente”, ma con materiale inquinato; altro dato importante è la sostenuta reazione immunitaria del Paziente con un’importante produzione di anticorpi IgM, cioè attuali, le IgG sono quelle di memoria, cioè pregresse.
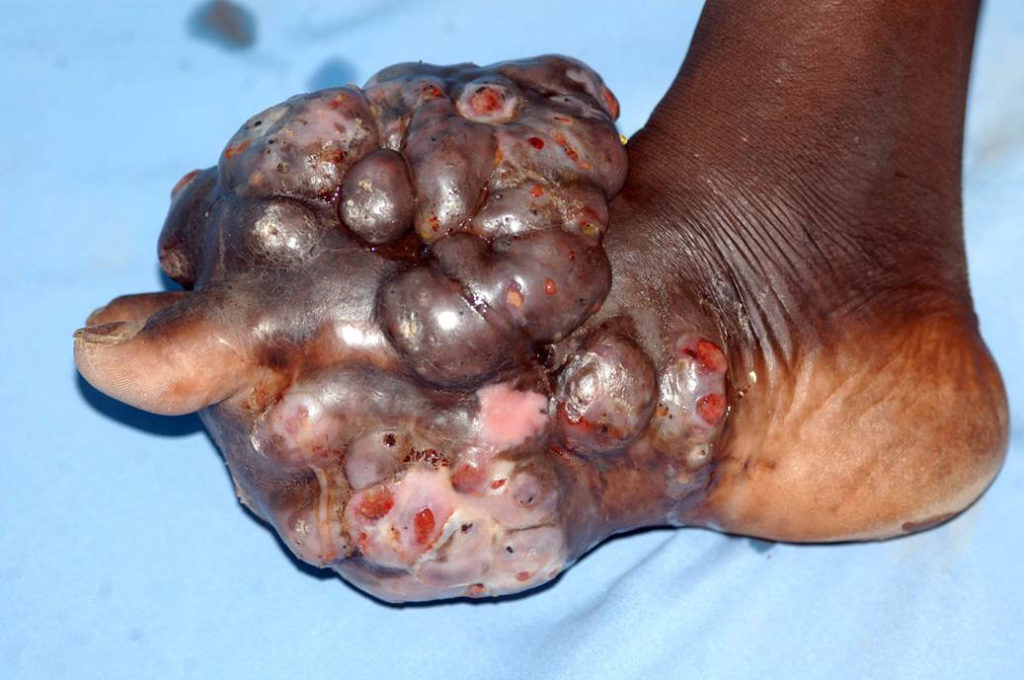
Le manifestazioni cliniche da considerare con i rispettivi patogeni sono 4:
– micetoma (tumore da fungo) noto come “piede di Madura”, città di Giava est, Indonesia, infezione distrettuale con ascessi aggressivi pseudo-tumorali che si ulcerano e fistolizzano potendo invadere persino il tessuto osseo. I responsabili: Madurella mycetomatis e M. grisea (grigia), ascomiceti filamentosi. Qui l’unica terapia è chirurgica, demolitiva (!);
– sporotricosi da Sporothrix schenckii, Ascomiceta (->), la cui espressione patologica è la “malattia del gestore di rose” il giardiniere: l’esordio clinico da replicazione avviene nel tessuto sottocutaneo nel punto di inoculazione traumatica e se diventa disseminata, può provocare infezioni drammatiche e devastanti ai polmoni, ossa e articolazioni, al globo oculare, al massiccio facciale ed alle meningi;
– cromoblastomicosi è un’infezione cutanea (fonte) che colpisce persone normali anche dal punto di vista immunitario preferibilmente delle zone tropicali o subtropicali con il Sud del Madagascar in prima linea (zona desertica ad Ovest e foresta pluviale ad Est) che si pungono o feriscono, anche minimamente, con spine e schegge che albergano questi funghi. L’infezione è caratterizzata dalla formazione di noduli papillomatosi, verrucosi iperplastici che tendono a ulcerare. Gli agenti: funghi filamentosi dal colore marrone scuro o nero detti demaziacei (etimo sconosciuto), caratterizzati da una parete che presenta anche melanina (funghi pigmentati); essi caratteristicamente producono granulomi nella zona infettata e sono: Fonsecaea pedrosoi, Phialophora verrucosa e Cladophialophora carrionii;
– feoifomicosi sono rare infezioni, sempre da funghi demaziacei pigmentati dei tessuti cutanei, superficiali e profondi, in particolare del cervello dove si formano cavità cistiche, prediligono soggetti immunocompromessi ed ovviamente sono talora fatali.
– f) MICOSI ESOGENE: causata da miceti ambientali presenti nel terreno, sui vegetali, nelle acque, come i cosiddetti Saprobi (etimo già detto: dal Gr. σαπρός, putrefatto, corrotto e βίος, vita) vocabolo che indica organismi che vivono in ambiente con materiale organico in decomposizione. Le patologie: Aspergillosi, Criptococcosi, specie Dimorfi con l’Histoplasmosi in primo piano.
– g) MICOSI SISTEMICHE o PROFONDE, ESOGENE e ENDOGENE: ne parlo insieme per evitare sovrapposizioni di patogeni e clinica.
Qui massima reazione immunitaria da parte dell’ospite, modesta invece se immunodepresso. Le micosi profonde sono causate da agenti patogeni fungini primari e opportunistici, ESOGENI o ENDOGENI, che inizialmente colonizzano il polmone, per poi diffondere in altri organi come cervello, cuore, fegato, milza, surreni e reni. I funghi responsabili sono: Blastomyces dermatitidis, Coccidioides, Histoplasma capsulatum e Paracoccidioides brasiliensis.
Gli opportunisti, che causano micosi profonda e malattia disseminata, percorrono ed invadono l’organismo attraverso il tratto respiratorio, il tratto alimentare o i dispositivi intravascolari e sono: Blastoschizomyces capitatus e Trichosporon spp. con il T. asahii, il responsabile più aggressivo e frequente, lieviti che causano nei neutropenici (ricordo che i granulociti neutrofili sono splendidi fagociti della linea midollare rossa!) infezioni disseminate talora mortali, Aspergillus spp. (spp = specie) , Candida spp, Malassezia furfur, Talaromyces o Penicillium marneffei.
Specialmente nei pazienti neutropenici (fonte), varie muffe ambientali, comprese le specie di Fusarium e Scedosporium apiospermum, che sono sempre più frequenti, possono causare lesioni vasculitiche angioinvasive focali, (ragazzi, ricordatevi l’Amico Virchow con la trombofilia!, modulo n. 3, lezione n. 11) che ricordano molto l’aspergillosi invasiva).
La maggior parte dei casi di micosi profonde primarie sono infezioni asintomatiche o clinicamente lievi che si verificano in pazienti normali che vivono o viaggiano in aree endemiche. Tuttavia, i pazienti esposti a un elevato inoculo di organismi o quelli con difese alterate possono subire una progressione potenzialmente letale o la riattivazione di focolai latenti di infezione.
I principali agenti patogeni sistemici: Aspergillus spp, soprattutto fumigatus, Blastomyces dermatitidis, Coccidioides immitis, Histoplasma capsulatum, Paracoccidioides brasiliensis.
I funghi dimorfici: Blastomyces dermatitidis, Coccydioides immitis, Histoplasma capsulatum, Paracoccidioides brasiliensis, Penicillium marneffei, Sporothrix schenckii e alcuni funghi opportunistici come Candida albicans e Penicillium marneffei.
– i) Genere di FUNGHI di interesse clinico, in ordine alfabetico.
Ascomycetes: dal Gr. ascos, sacco, dove alloggiano le spore, acospore, è una classe di funghi
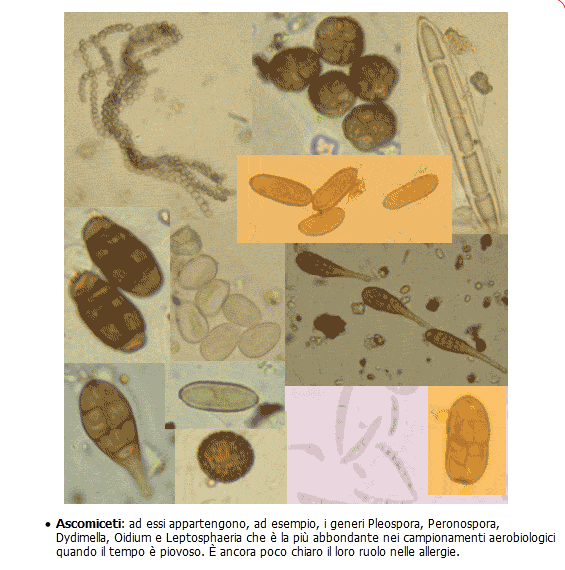
filamentosi, con micelio di norma pluricellulare, agenti della maggior parte delle micosi umane comprendenti circa (fonte) il 75% di tutte le specie di funghi catalogati compresi i tartufi, la maggior parte dei patogeni delle piante e quelli che si associano ad alghe o a cianobatteri per formare i licheni. Comprende: Aspergilli spp, Epidermophyton, Madurella mycetomatis e M. grisea, Microsporum, Sporothrix shenckii e Trichophyton.
Aspergillus spp.: miceti filamentosi della classe degli Ascomiceti (-<), ad ampia diffusione ambientale, comprendente 3 generi principali (fonte): fumigatus, la specie clinicamente più importante, A. niger ed A. flavus. Il fumigatus è la specie responsabile di circa il 90% delle aspergillosi sistemiche con polmonite letale, o granulomi, l’aspergilloma, ma anche, nel decorso clinico tremendo, implacabile, con sinusite che avanza nel massiccio facciale con ascessi cerebrali nei pazienti neutropenici e con monocitopenia (i monociti si attivano a macrofagi) per compromissione fagocitaria della linea mieloide midollare: da qui il fallimento di offrire un’efficace
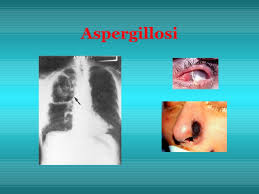
risposta immunitaria. Termofilo, cresce egregiamente a temperature di 39 – 40 °C. Il loro micelio con ife specializzate, produce i conidi, piccole cellule disperse nell’aria, stabili nell’atmosfera e capaci di entrare negli alveoli umani. Invadendo i vasi sanguigni, le ife dell’Aspergillus provocano trombi (lesione dell’endotelio e trombosi: Virchow Amico, ricordatelo!) con infarto del tessuto a valle, fenomeno drammatico soprattutto nei trapiantati, con ovvi e gravi episodi di rigetto. Nei pazienti con fibrosi cistica, la mucoviscidosi ereditaria, (fonte) l’Asp. fumigatus è al primo posto quale micete patogeno. Le sue spore inalate e intrappolate nelle dense secrezioni bronchiali possono germinare e quindi colonizzare il tratto respiratorio (polmonite) ed i seni paranasali (sinusite).
Blastomycosis dermatitidis: dal Gr. blasto, germe, embrione e blastoma, crescita abnorme del…), è un lievito opportunista (fonte) che vive in ambienti umidi su terreni con legname e foglie in decomposizione, in USA e Canada. Le spore vengono inspirate con decorso di solito cronicizzante. L’organismo reagisce con una reazione granulomatosa spesso associata a una marcata reazione fibrotica. La diffusione avviene più comunemente su cute, ossa e prostata.
GRANULOMA: neoformazione benigna di natura infiammatoria cronica caratterizzata da un nucleo centrale necrotico, da una corona di macrofagi, neutrofili e linfociti, connettivo e capillari neoformati con una capsula di tessuto sclero-cicatriziale prodotta dai fibroblasti.
Candida spp: (Monilia, sinonimo, termine obsoleto): dal Lat. candidus, bianco. Sebbene esistano oltre 200 specie di Candida, cinque delle loro diverse specie causano il 90% della candidosi sistemica con peculiarità del dimorfismo, che spesso blocca la funzione fagocitaria dei macrofagi (!) e sono: Candida tropicalis, C. parapsilosis, C. glabrata, C. krusei, che relativamente spesso ho ritrovato negli esami colturali dell’apice del CVC (catetere venoso centrale) di pazienti febbrili, ma dopo la più frequente Candida albicans, clinicamente la più rilevante perchè più comunemente isolata e soprattutto patogena, commensale umano nei distretti preferenziali, rappresentati da cavo orale in aerobiosi, adattandosi in modo eccellente alla mucosa del tratto gastro-intestinale ad alto pH ed in anaerobiosi e a quella della vagina, a basso pH. E’ dimorfo, presentandosi come lievito e ife. È in grado di crescere bene a temperature febbrili umane di 39 ° C-40 ° C (come l’Asp. fumigatus). Può penetrare nei tessuti ospiti con cellule ifali e ha molteplici molecole di adesione per facilitare la loro azione di perforazione della punta. Una serie di enzimi litici adatti alla digestione delle macromolecole umane viene indotta durante l’invasione dei tessuti.
A livello cutaneo le sue infezioni invadono profondamente l’epidermide e gli annessi cutanei: unghie,
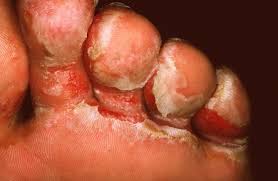
capelli e peli e importante è la reazione immunitaria da parte dell’ospite.
Le lesioni (fonte) appaiono come chiazze ben circoscritte, rosse, a volte pruriginose di varie dimensioni e forme, generalmente cerchiate con piccole pustole a base rossa e compaiono comunemente in pliche della cute come le ascelle, sotto il seno, dell’addome detto pendulo e del gomito, in area periombelicale, alle pliche dell’inguine, tra quelle dei glutei come nella dermatite da pannolino o pannolone, tra le dita dei piedi per l’umidità (!!!) ed infine intorno all’ano, denominata candidosi perianale. Croste possono formarsi anche sul cuoio capelluto e l’infezione può diffondersi anche al viso.
Intorno alle unghie (paronichia da candida). Questa infezione inizia di solito come un gonfiore doloroso che successivamente genera pus a livello subunguale talora con perdita delle unghie delle mani o più frequentemente dei piedi.
Candidosi orale, il mughetto: di solito appare dapprima come chiazze o piaghe bianche cremose
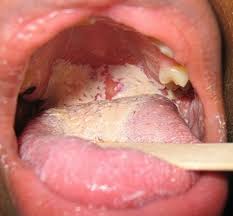
sulla lingua o sulle mucose della bocca. Se interessa le commissure labiali, arrossate per flogosi e infezione, erose e screpolate, si parla di perlèche.
Vulvovaginite: le donne in gravidanza o con diabete sono particolarmente esposte a questa comune infezione fungina. Di solito appare prima come una densa secrezione vaginale bianca o gialla (leucorrea) dall’odore dolciatro di lievito, con prurito e arrossamento dei genitali. Comunque l’agente più frequente di questa patologia è il batterio Trichomonas Vaginalis.
Pene: l’infezione del glande, sul solco balano-prepuziale, non è rara nei pazienti con fimosi e diabete ed in quelli con partner sessuali portatrici di vulvovaginite da candida.
A livello sistemico la candidosi invasiva assume molte espressioni cliniche a seconda del contesto in cui un ospite si ammala, poiché, una delle cause importanti è che il lievito non è più dominato dai batteri “buoni” del microbiota per mortificazione della flora batterica normale da parte degli antibiotici ad ampio spettro spesso purtroppo da patologia iatrogena (!) (modulo n. 6, lezione n. 22) con severe criticità nel Paziente.
I principali fattori di rischio in tale contesto sono l’uso di cateteri venosi centrali, l’esposizione ad antibiotici ad ampio spettro come detto prima, senescenza soprattutto con alcolismo e malnutrizione, ricoveri ospedalieri di lunga durata, diabete mellito, gravidanza; anche i neonati possono essere infettati dalla madre malata ed infine la neutropenia o agranulocitosi (modulo n. 3, lezione n. 10), fenomeno non raro nei pazienti oncologici in TCX per la possibile trasmigrazione intestinale della Candida nel sangue portale e quindi ascessi epatici, ma non cerebrali, fenomeno questo rilevabile invece nei neonati prematuri con candidosi data la loro immaturità della barriera ematoliquorale, permeabile.
Clinicamente si assiste (fonte) ad un amplissimo spettro di infezioni da lieviti di diverse specie di Candida. È una grave infezione piuttosto comune nei pazienti a lungo ospedalizzati che con la candidemia può raggiungere l’endocardio, il cervello, la retina, fegato e milza, reni e surreni, di rado provoca osteomielite o altro di rarissimo.
Comunque la forma più comune e grave, come detto prima, anche per la tipologia complessa del Paziente, e la diffusione, è la candidemia la cui sindrome (insieme di segni e sintomi) comprende febbre, ovviamente non rispondente agli antibiotici, brividi, ipotensione, conta dei leucociti poco affidabile per < o >, più l’impegno dell’organo maggiormente colpito. Peculiarità già prima riportata: la Candida prospera anche a temperature corporee di 39 – 40° C. ed un altro dato fondamentale (fonte) è che riesce a “camuffare”, fenomeno detto resistenza, un suo recettore parietale per eludere l’attività dei macrofagi e forse anche quella dei granulociti neutrofili, che amano però preferenzialmente i batteri. Una cosa è certa (fonte): non esiste correlazione tra candida e cancro. Forse qualcosa è da capire per il cancro del pancreas e la presenza di funghi del genere Malassezia (->) nel suo parenchima di provenienza dal microbiota intestinale.
Coccidioides immitis e C. posadasii: coccidi dal Gr. kokkis, bacca piccola e immitis dal Lat, duro, per il complesso decorso clinico; posadasis proviene da Alejandro Posadas, chirurgo e parassitologo argentino. Questi sono funghi (fonte) del suolo negli USA e nell’America del Sud e la coccidioidomicosi o Febbre della Valle è una malattia polmonare per inspirazione delle spore o a diffusione ematogena disseminata, di solito a carattere benigno; rara la forma sistemica con lesioni focali pluridistrettuali. La maggior parte dei casi sono infezioni clinicamente occulte o lievi in pazienti che inalano artroconidi infettivi. Tuttavia, eccezionalmente, alcuni pazienti immuno-compromessi affrontano un’infezione polmonare progressiva e possono anche presentare diffusione al cervello, alle ossa e ad altri siti. La meningite da coccidioide è un’infezione potenzialmente letale che richiede un trattamento permanente. Cryptococcus neoformans: (dal Gr. crypto, nascosto e dal Lat. coccus, cioè dalla forma ovalare). E’ un saprofita molto diffuso nell’ambiente, abbonda negli escrementi e nelle carcasse di piccione ed è l’unico fungo provvisto di una spessa capsula polisaccaridica, importante fattore di virulenza. La Cryptococcosi può presentarsi come semplice colonizzazione innocua nelle vie respiratorie o come un’infezione polmonare con eventuale disseminazione i cui sintomi sono quelli della polmonite, della meningite, o del coinvolgimento di pelle, ossa o visceri. Ovviamente la prognosi, un tempo infausta per la progressione dell’infezione, è funzione della diagnosi e della terapia tempestiva.
Dermatofizie o dermatofiti, meglio dermatomicosi (dal Gr. dérma, pelle o cute e dal Lat. – phyto, pianta, ma anche vegetazione per crescita abnorme). Ma i dermatofiti sono miceti, non piante!
I dermatofiti responsabili (fonte) appartengono agli Ascomiceti (<-) e sono l’Epidermophyton, il Microsporum, ed il Trichophyton spp (specie), muffe che si nutrono della cheratina (dal Gr. κέρας, corno) sclero-proteina complessa filamentosa costituita da lunghe catene ad elica di amminoacidi anche solforati, come la cistina (formata da 2 molecole di cisteina), con oligoelementi. Diffusa in tutto il regno animale, nell’uomo rappresenta il principale costituente di peli, capelli ed unghie rilevabile nello strato esterno della cute dove i dermatofiti sopravvivono. Questi agenti patogeni sono in grado (fonte) di produrre e secernere cheratinasi, lipasi, proteasi e fosfatasi, che favoriscono la diffusione delle ife in via di sviluppo attraverso lo strato di cheratina, che se intatto, inibisce la penetrazione negli strati più profondi dell’epidermide, almeno inizialmente. Il mannano (già visto in – 3) DIMENSIONI, STRUTTURA e FORME) è una glicoproteina della loro parete cellulare che non solo inibisce la proliferazione dei cheratinociti, ma, soprattutto, inibisce lo sviluppo dell’immunità mediata dai Linfociti T, i primi ad essere impegnati (ragazzi vi ricordo il ruolo dei Linfociti T nei virus, funghi e TBC). Comunque si ritiene che gli anticorpi umorali non giochino ruoli nell’immunità nei confronti dei dermatofiti.
Le infezioni da dermatofiti vengono a volte chiamate tigna o tinea (dal Lat. verme, tarlo, ma con i vermi non c’entra nulla, così come già visto con il suffisso -fiti, perché non sono piante).
Le loro infezioni possono presentarsi quasi ovunque sulla cute con eruzioni, desquamazione e prurito. Ecco le espressioni per il sito di comparsa:
cuoio capelluto, tigna o tinea capitis,
barba, tinea barbae,
unghie, tinea unguium o onicomicosi,

corpo, tinea corporis,
inguine, tinea cruris,
piedi (piede d’atleta), tinea pedis.
Questi organismi potrebbero vivere sul nostro corpo senza manifestazione infettiva, ma quando ciò avviene, ci troviamo in situazione di zone ischemiche, come anche nella microangiopatia diabetica (modulo n. 4, lezione n. 18), ovvero in pazienti immunodepressi.
Epidermophyton: Ascomycete -> dermatofizie.
Fusarium: dal Lat. fuso, muffa ambientale, le cui spp causano infezioni superficiali tipo cheratite ed onicomicosi, in pazienti immunocompetenti ed infezioni disseminate in pazienti gravemente immunocompromessi con neutropenia grave prolungata e/o grave immunodeficienza dei Linfociti T. Histoplasmosis capsulatum: dal Lat. histo, tessuto e dal Gr. πλάσμα, plasma, figura. Fungo dimorfico: tale passaggio intermittente dalla forma di lievito a quella di ife crea una varietà (pleiomorfismo) antigenica che inibisce, “sconcerta” la risposta immunitaria dell’ospite e questo fenomeno è caratteristico anche della Sporotrix schenkii (->) e del Penicillum marneffei (->). In clinica l’istoplasmosi è un’infezione polmonare primaria derivante dall’inalazione dei conidi, la cui diffusione ai linfonodi ilari e mediastinici (mediastinite fibrosante), milza, fegato, midollo osseo e cervello può essere pericolosa per la vita dei neonati e di altri pazienti immunocompromessi. L’istoplasmosi è caratterizzata dalla crescita del fungo all’interno dei macrofagi con reazione distrettuale, macro- o microscopica da granuloma (ripeto la definizione: neoformazione benigna di natura infiammatoria cronica caratterizzata da un nucleo centrale necrotico, da una corona di macrofagi, neutrofili e linfociti, connettivo e capillari neoformati con una capsula di tessuto sclero-cicatriziale prodotta dai fibroblasti). Da questi nuclei granulomatosi i funghi si possono virulentare, alimentando la loro diffusione in altri siti.
Per inciso questi comportamenti sono sovrapponibili a quelli da Mycobacterium tubercolosis con infezione primaria e riattivazione dallo sviluppo dei bacilli all’interno dei macrofagi: TBC, argomento che non ho ancora affrontato! Amo l’etimologia: tubercolo, dal Lat. tuberculum, piccolo tumore, escrescenza, ma anche piccolo granuloma, in quanto il tubercolo nella TBC ha un’evoluzione complessa: si parte da essudato che si infiltra negli interstizi alveolo-capillari e sub-pleurici con fenomeni necrotici ed un mix giallastro ricco di bacilli, pastoso simil formaggio, con l’aggettivo appunto di caseoso (necrosi caseosa).
Madurella mycetomatis e M. grisea (grigia): dal nome della città di Madurai, India del Sud. Sono ascomiceti filamentosi, nominati nelle micosi sottocutanee (<-).
Malassezia furfur: il nome deriva dallo scienziato francese Louis-Charles Malassez e la forfora è l’espressione di un’intensa desquamazione delle cellule del cuoio capelluto, i cheratinociti, stimolati ad un repentino ed eccessivo ricambio. La Malassezia è‘ un lievito commensale dimorfico, tipico della cute umana che in caso di umidità locali protratte favorisce un’anomala produzione di sebo; ma come opportunista, aspetta i “classici tempi brutti” del Paziente per diventare patogeno, colpisce in genere i lattanti cateterizzati e gli adulti debilitati che ricevono infusioni parenterali con lipidi. (fonte). Come
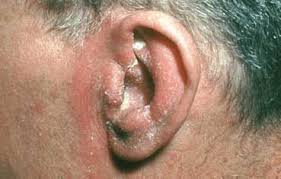
detto, dimorfico, pertanto esiste in due forme morfologiche: uno stato di lievito che una volta era chiamato Pityrosporum ovale e una fase miceliale che è la forma patogena. Ed ecco che localmente abbiamo la Dermatite seborroica e la Pitiriasi o tinea versicolor che si manifesta con chiazze desquamate multiple e asintomatiche con vari colori: bianche, rosa, rosa salmone, marrone chiaro o scuro. Eccezionali le localizzazioni sistemiche faringee e sinusitiche, nonché le artriti.
Interessantissime novità su questo fungo “della forfora” forse implicato nel cancro del pancreas (fonte del 4 ottobre 2019). E’ un lavoro, quello pubblicato su Nature, che potrebbe segnare un punto di svolta in questo campo oncologico, risultato di una serie di eleganti ricerche che suggeriscono un possibile nesso causale tra un pattern particolare di micobioma del microbioma (modulo n. 11, lezione n. 30) caratterizzato da un’iperproliferazione di tali funghi con infiammazione generata dalla attivazione del complemento, elemento dell’immunità innata (vedi modulo n. 19, lezione n. 43 verso la fine). Gli Autori dello studio sospettano che questo fungo non stia lì per caso, ma che possa essere addirittura implicato nella progressione malattia.
Micorrize: (dal Gr. mýkēs, fungo e rhíza radice). Molte di queste specie appartengono alla famiglia dei Zigomiceti (->), funghi che vivono nel terreno o su materiale organico vegetale o animale in decomposizione.
Microsporon: Ascomycete -> dermatofizie.
Paracoccidioides brasiliensis: (dal Gr. simil coccioides, cioè tipo piccole bacche, è un fungo (fonte) termicamente dimorfico, muffa a 25° C e lievito a 37° C, dall’habitat naturale sconosciuto, le cui infezioni sono state segnalate appunto in Brasile ed in Paesi limitrofi quali reali micosi endemiche e sistemiche dette paracoccidioidomicosi con quadri clinici variabilissimi. La via di ingresso è verosimilmente da inalazione dei conidi con infezione primaria dei polmoni grazie alla serina-proteinasi, enzima esocellulare che promuove l’invasione dei tessuti. La forma disseminata coinvolge il sistema reticoloendoteliale (sistema immunitario dei fagociti, diffuso), la cute, le mucose, i linfonodi.
Penicillium o Talaromyces marneffei: (penicillium, dal Lat. pennello del pittore come le catene di conidi che ricordano una scopa e marneffei, da Marneffe, villaggio belga). E’ un fungo opportunista e dimorfico patogeno in pazienti del Sud-Est asiatico con AIDS; casi sono stati segnalati in viaggiatori di ritorno dopo visite nella suddetta regione. Le loro lesioni cutanee possono ricordare il mollusco contagioso dei Poxvirus (modulo 20, lezione n. 44, vai a -15) Poxviridae della classificazione). Pneumocystis carinii o jirovecii, (dal Lat. pneumo, polmone e cystis, cisti; carinii, di Carini, comune palermitano e l’ultimo aggettivo in onore dell’accademico ceco Otto Jírovec): fungo patogeno opportunista nell’uomo sano, nel soggetto immunodepresso diventa marker dell’AIDS di solito con < dei Linfociti T CD4+, evidenziati dall’esame di Lab. già riferito, detto sottopopolazioni linfocitarie, ed è molto comune anche tra i pazienti pediatrici affetti da HIV, pur interessando anche i soggetti in terapia cronica con corticosteroidi, i trapiantati ed i portatori di linfomi e leucemie.
Il fungo, in tali pazienti, presenta un’adesione caratteristica alle cellule ciliate dei bronchi ed a quelle alveolari, proliferando e resistendo all’azione dei macrofagi. Nel parenchima polmonare provoca una polmonite interstiziale (come il Covid-19) con infiltrato caratteristico di plasmacellule e possibile malattia sistemica per disseminazione ematica. Severo è il quadro clinico complesso, mortale in 1 paziente/5.
Scedosporium apiospermum e Sc. prolificans: (etimologia non trovata, mentre l’apio è un legume sudamericano). Sono muffe ambientali pressoché ubiquitarie. Le loro spore (fonte) possono essere inalate oppure inoculate attraverso lesioni traumatiche della cute. Nei pazienti con fibrosi cistica, le spore fungine inalate e intrappolate nelle dense secrezioni bronchiali possono germinare e quindi colonizzare il tratto respiratorio; meno frequentemente, le spore possono raggiungere i seni paranasali dando una sinusite. Dati recenti sostengono che Scedosporium è al secondo posto, dopo l’ Aspergillus fumigatus (->), tra i funghi filamentosi isolati dalle secrezioni respiratorie dei pazienti con fibrosi cistica. L’incidenza di questa infezione (fonte) è in costante aumento nei pazienti con neutropenia acquisita da TCX o da trapianto di midollo osseo.
Sporotrix shenckii: (etimo: spore pelose e l’aggettivo proviene dal Medico tedesco Giovanni Teodoro Schenckio) è un Ascomycete (fonte), muffa saprofita e con dimorfismo: tale passaggio intermittente
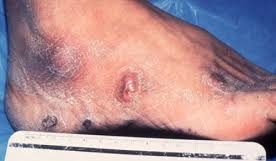
dalla forma di lievito a quella di ife crea una varietà (pleiomorfismo) antigenica che inibisce, “sconcerta”(verbo più volte impiegato, che mi piace perchè esplicito) la risposta immunitaria dell’ospite e questo fenomeno è caratteristico anche dell’Histoplasma capsulatum e del Penicillum marneffei. Per inoculazione trans-cutanea da puntura di spina di rosa (già detto: la “malattia del gestore di rose“) su zone esposte come mani, braccia, viso e piedi, è da considerarsi tra le malattie professionale di giardinieri ed altro, diventa lievito, provocando l’infezione detta sporotricosi, con comparsa di noduli cutanei indolori che si diffondono per via linfatica “a catena di rosario” ed evolvono in ascessi e ulcere con possibile sovrapposizione batterica, espressione letale se si va incontro a setticemia con localizzazioni multiple varie ed ovviamente, ormai lo abbiamo imparato, solo nei pazienti con immunodepressione. Raramente le spore depositate sui muschi vengono inalate, potendo infettare bronchi ed alveoli con infiltrati localizzati o con cavità, il più delle volte in pazienti con patologie croniche polmonari preesistenti.
Trichophyton: Ascomycete -> dermatofizie.
Trichosporon spp: (dal Gr. trichós, capello e spora) sono lieviti (fonte) responsabili di infezioni superficiali come la Piedra bianca (vedi avanti), polmonite allergica e più raramente di infezione invasiva. Negli anni ’80 erano considerate la seconda causa più comune di fungemia nei pazienti con neoplasie ematologiche dopo la candidemia. Ritorno di numerosi casi clinici negli ultimi 10 – 15 anni per nuove resistenze alle già affidabili terapie antifungine. Trichosporon asahii: è il lievito più aggressivo e frequente tra quelli che causano infezioni disseminate talora mortali nei pazienti neutropenici (ricordo che i granulociti neutrofili sono splendidi fagociti!). Trichosporon beigelii: è un lievito che provoca la malattia detta Piedra bianca, un’infezione superficiale della pelle, cuoio capelluto, capelli e peli pubici, recente patogeno opportunistico degli immunodepressi. E’ stato segnalato come agente di infezione disseminata in pazienti ematologici, oncologici o sottoposti a trapianto d’organo solido (vuol dire non midollo o cellule staminali): nella maggior parte dei casi l’infezione era conseguente ad uno stato di profonda neutropenia e quasi tutti i pazienti non ematologici erano in terapia con steroidi. I neonati prematuri e i pazienti ustionati rappresentano altri gruppi di pazienti in cui è stata descritta fungemia da T. beigelii. Si ritiene che la colonizzazione del tratto gastro-intestinale e del catetere venoso centrale rappresentino una potenziale via di penetrazione per questo microrganismo.
Zygomycetes: dal Gr. ζυγος, giogo, per la forma delle spore, sono funghi parassiti filamentosi, il cui corpo è il micelio, il classico intreccio di ife, lunghi filamenti cellulari; sopravvivono nella materia organica in decomposizione ed ovviamente nelle cellule degli organismi parassitati, osservandosi, cosa eccezionale, (fonte), il parassitismo con altri funghi dello stesso specie, un cannibalismo micotico! Le forme sistemiche di zigomicosi sono dette anche mucormicosi. Sono infezioni fortunatamente
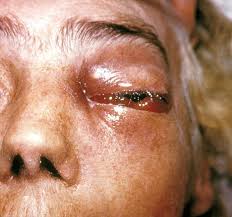
molto rare (fonte) perché la loro prognosi è quasi sempre infausta, in parte per la notevole velocità di propagazione di questi microorganismi, ma anche per la loro scarsa o nulla sensibilità ai farmaci antifungini. I principali fattori di rischio per l’insorgenza di zigomicosi si ritrovano, anche qui nei pazienti immunodepressi, aggiungendo però il diabete scompensato come frequenza particolare ed i politrasfusi in terapia chelante con la deferoxamina (contrasta il pericoloso accumulo epatico di ferro).
Nei soggetti normoergici, invece, le infezioni sistemiche da zigomiceti sono sempre conseguenza di una penetrazione traumatica del microrganismo. Sono descritte varie forme di zigomicosi invasiva. Relativamente frequente la forma rinocerebrale che di solito ha origine a livello dei seni paranasali in seguito all’inalazione di sporangiospore. Successivamente queste germinano ed il microrganismo diffonde velocemente interessando la cavità orbitale, il palato e la piramide nasale. In seguito le ife attraversano la lamina cribrosa dell’etmoide e penetrano nell’encefalo, portando il paziente rapidamente a morte. Anche per la Zigomicosi polmonare l’infezione è il risultato dell’inalazione delle sporangiospore e della loro localizzazione a livello dei bronchioli e degli alveoli, con conseguente infarto polmonare e necrosi. La forma gastrointestinale è molto rara, probabilmente secondaria ad ingestione degli elementi fungini, e di solito è associata a grave malnutrizione, soprattutto nei bambini e a malattie gastrointestinali che alterano l’integritàdella mucosa dove si repertano ulcere necrotiche. Ognuna di queste forme può essere fonte di zigomicosi disseminata, a volte con localizzazione cerebrale.
 daddydoctorgym.com il sito dove trovare alcuni consigli per il buon uso della palestra e la donazione di sangue
daddydoctorgym.com il sito dove trovare alcuni consigli per il buon uso della palestra e la donazione di sangue




3 commenti
Pingback: Scienze Infermieristiche e Corso OSS Dierreform: programma di Medicina, Dr. Stefano Graziani - daddydoctorgym.com
Pingback: Scienze Infermieristiche e Corso OSS DierreForm, Medicina: Patologie fisiche (lezioni 20 -> 22, modulo 6) - daddydoctorgym.com
Pingback: Nuovo Corso OSS: cenni di Pediatria. Modulo n. 4/nc - daddydoctorgym.com