Scienze Infermieristiche e Corso OSS. Lezione n. 43, modulo n. 19.
La tipologia di esposizione dell’argomento in numerosi passi potrebbe essere molto complessa per l’OSS, non però per Infermieri e Medici. Comunque buona lettura e ci chiariremo in aula, ma non per ora, per il Coronavirus.
Lezione n. 43: Batteri: cosa sono e loro caratteristiche biologiche.
ORGANIZZAZIONE della lezione per TEMI:
Introduzione
Ambiente
Forme
Dimensioni
Struttura
Produzione di energia
Nutrizione
Riproduzione batterica
Modalità di ingresso nell’Uomo
Virulenza
Esotossine
Superantigeni
Anatossine
Endotossine
Citochine
Antibiotici (cenni).
INTRODUZIONE. Batterio, etimologia: dal Gr. baktḗrion, bastoncino. con sinonimo germe e monera (dal Gr. moneres, solitario, unico). Cinque sono i regni biologici della natura: degli animali, delle piante, dei miceti, delle monere (sinonimo batteri) e dei protisti, gruppo di organismi eucarioti, generalmente unicellulari, autotrofi o eterotrofi, con caratteristiche proprie sia delle piante che degli animali, eterogeneo e polifiletico, cioè senza un comune antenato non inseribili negli altri tre regni e senza tessuti altamente specializzati, come le alghe, il fitoplancton e i protozoi. si possono distinguere in tre grandi raggruppamenti (fonte): protisti autotrofi, fotosintetici per la clorofilla, assimilabili alle piante; protisti eterotrofi o protozoi, assimilabili agli animali; protisti saprofiti, che si nutrono per assorbimento, assimilabili ai funghi.
Con il termine di microbo o microbio (vita microscopica), si intendono vari elementi biologici con, oltre i batteri, i virus, i citomegalovirus (derivati dalla famiglia dell’Herpes che determinano un > patologico del volume delle cellule colpite) ed altri microrganismi patogeni unicellulari come i protozoi (dal Gr. proto, primo e zoarion, animaluccio), organismi unicellulari eucarioti, cioè con nucleo, i batteri sono procarioti, senza questo elemento.

Ai tempi del mio servizio in Chirurgia al “Renzetti” di Lanciano, ero membro del CIO, il Comitato Aziendale per il controllo delle Infezioni Ospedaliere, organo tecnico-scientifico con il compito di vigilare e presidiare gli aspetti relativi al controllo delle infezioni trasmesse in ambito ospedaliero. Da qui l’articolo pubblicato nel gennaio 2011 dal titolo “Infezione della ferita chirurgica (SSI: Surgical Site Infection)” che fino ad oggi ha ottenuto 10.187 visualizzazioni soprattutto con il tag:
Proprio 9 anni fa, il 26 marzo, 2011, oggi è il 19 marzo 2020, ho pubblicato uno splendido e prezioso articolo dal titolo “Germi difficili del III° millennio: report della Dr.ssa Ines Bianco”, Dirigente Medico Responsabile U.O.S. Microbiologia, Ospedale “Renzetti”, Lanciano (Ch).
8.547 visualizzazioni ad oggi! Dove troverete la parola (link) andrete a quell’articolo. Grazie ancora ad Ines.
Parlando di infezioni batteriche e più in là anche di quelle virali (come visto all’inizio, siamo a marzo 2020 in pieno dramma da Coronavirus) e quindi di quelle micotiche (fungine) … ancora più in là, consiglio un “ripasso” dei nostri poteri immunitari, che ricordo essere la fagocitosi e la produzione di anticorpi (immunoglobuline) descritti nella lezione n. 5 del modulo 2.
Ma i batteri (BB) non sono soltanto nemici, ma anche amici, come descritto nella lezione n. 30 del modulo 11: Il MICROBIOTA INTESTINALE, pubblicato nel dicembre 2016 con numerosi aggiornamenti.
I BB sono microrganismi unicellulari, procarioti, già detto sopra cioè senza nucleo ma comunque provvisti di “gomitoli di DNA” dell’ordine di alcuni millesimi di mm., i micrometri, visibili pertanto al microscopio ottico con la batterioscopia, presenti in comunità di milioni e miliardi di unità in un solo gr. di terreno (fonte), 1 ml. di acqua dolce di solito contiene circa 1 milione di cellule batteriche: da ciò si evince che gran parte della biomassa terrestre sia costituita da batteri!
Nel nostro corpo, sulla cute e negli organi che sono in relazione con l’esterno, cioè apparato respiratorio, uro-genitale ed apparato digerente, ma soprattutto nel grosso intestino (colon, crasso sinonimi), il peso complessivo dei batteri è di circa 1 Kg e 500 gr.(!).
AMBIENTE. Ovunque! Dentro di noi ed al di fuori di noi, nella terra, nell’acqua, nelle piante, negli animali, nei rifiuti radioattivi, nelle profondità della crosta terrestre e degli oceani (fino a 10.000 m. di profondità), nel ghiaccio artico, nei ghiacciai, nelle sorgenti calde e caldissime (200°C.), nella stratosfera, tra i 9.660 Km. ed i 48.000 Km.
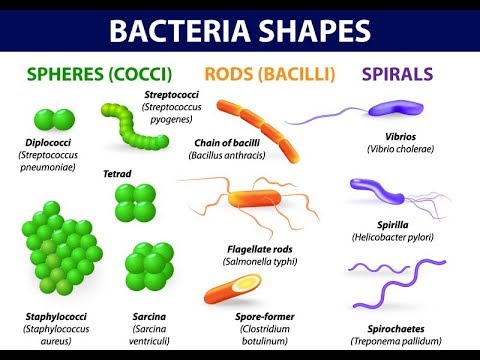
FORME: si presentano con tre aspetti:
la sferica: i cocchi (dal Gr. kòkkos, granello, cocciniglia);
a bastoncino retto: i bacilli, come il Mycobacterium tubercolosis e il bacillus anthracis ed
a bastoncino curvo, detti vibrioni come il Vibrio cholerae;
a spirale: le spirochete (a spirali multiple) come il treponema pallidum della sifilide (o lue), la Leptospira della leptospirosi classica o ittero-emorragica di Weil (zoonosi per lo più da urine di cani e ratti infette: è una malattia a poussées cliniche febbrili acute con interessamento epatico, renale e meningeo) e la Borrelia burgdorferi (malattia di Lyme, infezione trasmessa dalla puntura delle zecche infestate dalla spirocheta: rash cutaneo eritematoso migrante, al quale può seguire dopo settimane o mesi turbe neurologiche, cardiache o articolari), e
gli spirilli (a due o più spirali) come il Campilobacter e l’Helicobacter.
DIMENSIONI. Il micrometro, µm, corrisponde a un milionesimo di metro, cioè millesimo di mm., mentre per i virus parliamo di nanometri, nm, cioè di 1 miliardesimo di metro (simbolo nm ), 1 milionesimo di mm.. Le dimensioni dei BB variano da circa 0,2 µm dei micoplasmi, privi di parete cellulare e ritenuti responsabili di numerose affezioni genito-urinarie, ai 30 µm di alcune spirochete con il record del Thiomargarita namibiensis, ovvero “perla sulfurea della Namibia”, visibile ad occhio nudo per il suo diametro di circa 0,7 millimetri.
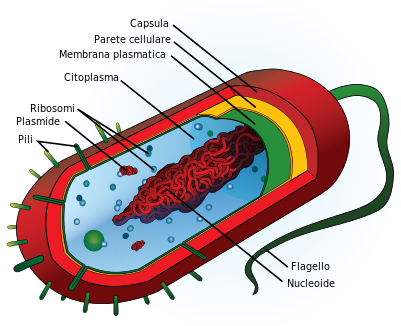
STRUTTURA. Osservando un batterio, la sua parte più esterna, a contatto con l’ambiente, è detta
capsula o glicocalice, di natura saccaridica, protegge il germe dalla fagocitosi, ma Brucelle, Micobatteri, Stafilococchi, Salmonelle resistono all’interno delle cellule fagocitarie! Vi è quindi la
parete batterica, struttura rigida di supporto strutturale composta dal peptidoglicano, un polimero glicoproteico, che funge da solida impalcatura della membrana cellulare dando così la forma al microbo, ha funzioni di difesa contro la fagocitosi e regola lo scambio di nutrienti e metaboliti con il mondo esterno (in sinergia con la membrana plasmatica); ed infine si osserva la
membrana citoplasmatica, con struttura asimmetrica, fosfolipide all’interno, lipopolisaccaride (LPS) all’esterno al quale è legata l’attività di endotossina (vedi avanti), caratteristica dei Gram-. Questa membrana risulta permeabile a varie molecole ed al suo interno troviamo il
citoplasma, sostanza gelatinosa che consente di ricavare energia da varie reazioni specifiche essendo assenti i mitocondri caratteristici delle cellule eucariotiche, contiene il materiale genetico, cioè il DNA di aspetto filamentoso come un cromosoma, con tutte le istruzioni genetiche utilizzate nello sviluppo e nella funzione del batterio ed i
ribosomi, responsabili della sintesi proteica, particelle complesse costituite da granuli ricchi di RNA.
Torniamo all’esterno della parete batterica, dove troviamo i flagelli e le fimbrie o pili, sinonimo.
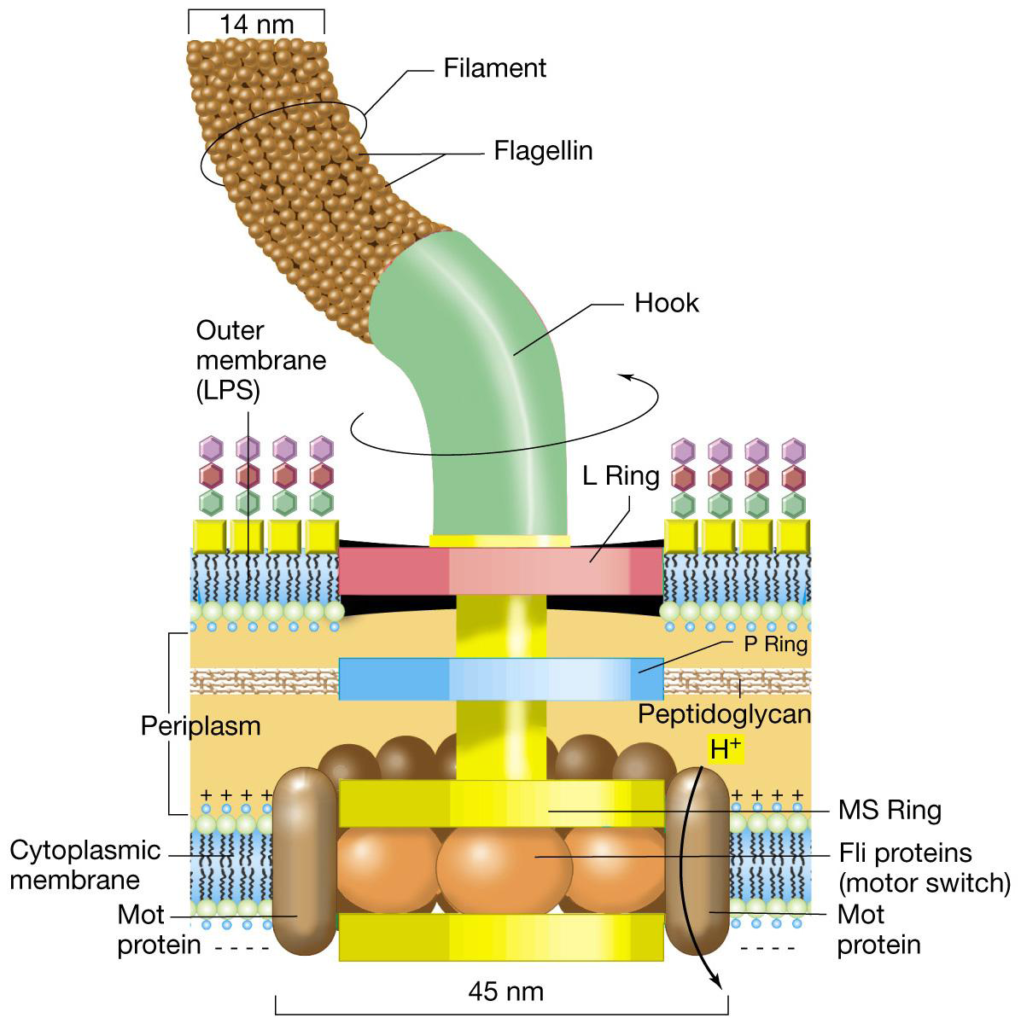
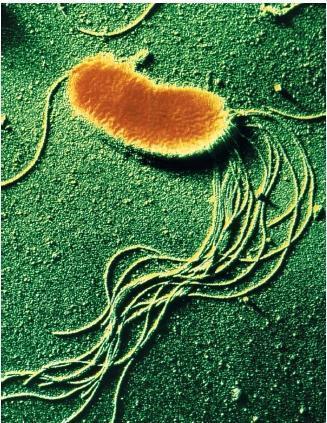
Flagelli o ciglia (fonte del 14 luglio 2019). Molte specie batteriche sono mobili per mezzo del flagello, organello filamentoso elicoidale che funge da vite molecolare per generare spinta; la sua struttura ed impianto sono versatili, adattandosi alle condizioni ambientali in cui essi vivono. Essi sembrano avere più funzioni oltre a quella della motilità, come la virulenza e l’adesività. Sono strutture sottili e rigide composte da polimeri proteici di flagellina, lunghi circa 5 volte più del corpo batterico, visibili soltanto al microscopio elettronico. La/le flagellina/e, proteina elastica (fonte), differisce nelle diverse specie batteriche per composizione aminoacidica e per peso molecolare, ed al plurale, sono dotate di spiccate proprietà antigeniche e possono essere recettori per i batteriofagi (virus che vedremo più avanti in: Trasferimento di materiale genetico). L’assemblaggio dei flagelli (fonte) è un processo ben regolato: la sintesi delle molecole di flagellina è in funzione della loro utilizzazione. Il flagello si inserisce a livello della membrana plasmatica e poi percorre verso l’esterno tutti gli altri strati, quindi peptidoglicano e membrana esterna se si tratta di un batterio Gram-.
Le specie batteriche differiscono in modo distintivo nel pattern di distribuzione dei flagelli, avremo così i batteri monotrichi con un solo elemento ad un polo cellulare, i batteri lofotrichi con un ciuffo di flagelli, sempre ad un polo, quelli anfitrichi con due flagelli ognuno ad un polo ed infine i batteri peritrichi che presentano flagelli lungo tutta la superficie cellulare. Le vie di segnalazione chemiotattica intracellulare regolano (fonte) la direzione della motilità guidata dal flagello in risposta ai cambiamenti locali, consentendo loro di spostarsi in ambienti più favorevoli.
Fimbrie o pili: sono strutture esterne, come i flagelli, contribuiscono molto alla diversità morfologica delle cellule batteriche e sono coinvolte in diverse funzioni fisiologiche, come il trasferimento di acidi nucleici ad altre cellule e l’adesione batterica alle cellule ospiti (vedi avanti). Le fimbrie sono più sottili e più corte dei flagelli, sono molto numerose sia su tutta la superficie cellulare che solo ai poli e sono formati da un’unica proteina, la pilina, che si assembla dall’interno della cellula verso l’esterno, molecola che è anche in grado, poiché molto mutevole, di ingannare il sistema immunitario. Alla superficie dei pili sono presenti altre proteine definite adesine che consentono al batterio di aderire e pertanto colonizzare gli epiteli delle mucose.
Colorazione GRAM, datata 1884, dal cognome del Batteriologo danese Prof. Hans Christian Gram che l’ha ideata: dipende dalla tipologia della struttura della parete batterica.
GRAM+ perché i germi prendono la colorazione blu-viola della procedura: la loro parete è composta,
come detto prima, essenzialmente dal peptidoglicano e sono rappresentati da tutti i Cocchi come streptococchi, stafilococchi (dal Gr. staphylḗ, grappolo), pneumococchi e dal Clostridium tetani, tranne il gonococco ed il meningococco che sono GRAM-. Caratteristica degli ultimi lustri è la loro antibiotico-resistenza (link), come lo Staphylococcus aureus resistente alla meticillina (MRSA) e l’Escherichia Coli (dal nome del biologo tedesco Theodor Escherich: 1857-1911) resistente ai beta-lattamici ESBL (Extended Spectrum Beta Lactamases).
Invece i batteri GRAM- non assumono la colorazione GRAM, rimanendo color rosa. La loro parete cellulare è composta sempre dal peptidoglicano, ma è estremamente sottile. Alcuni sono commensali cioè microrganismi “tranquilli”, non patogeni presenti nella normale flora intestinale, ma in casi particolari possono creare infezioni o favorire lo sviluppo di germi patogeni “dormienti”. Le loro infezioni sono meno frequenti di quelle da GRAM+ ma di solito sono più gravi, ricordando il colera (Vibrio cholerae), la peste (Yersinia pestis), la meningite da meningococco (Neisseria meningitidis), la gonorrea (Neisseria gonorrheae) ed il tifo
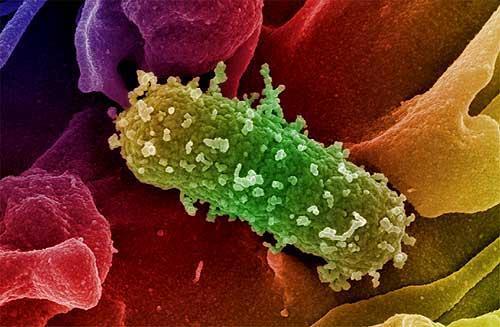
(Salmonella enterica), nonché infezioni delle vie urinarie, intestinali e di complicanze peritonitiche e setticemiche con lo Pseudomonas aeruginosa e l’Escherichia Coli.
PRODUZIONE di ENERGIA per la vita. I BB autotrofi producono energia attraverso la
fotosintesi (fotoautotrofi), usando luce solare, H2O e CO2, ricordando la “formula della vita al contrario”:
acqua (H2O) + anidride carbonica (CO2) + (E. sole) = glucosio (C6H12O6) + ossigeno (O2)
o con la
chemiosintesi (chemioautotrofi), servendosi di CO2, H2O e sostanze chimiche come azoto, zolfo, ammoniaca ed altri. Nei primi troviamo vegetali terrestri, alghe, fitoplancton ed i cianobatteri, produttori di O2 che probabilmente sono all’origine della vita, immettendolo nell’ambiente terrestre; nel secondo gruppo si trovano BB che riescono a crescere ricavando energia tramite l’ossidazione (perdita di un atomo di idrogeno) di composti del mondo minerale in ambienti privi di ossigeno, di radiazione solare e di materia organica, come i batteri nitrificanti, i solfobatteri e gli archeobatteri metanogeni. Essi si si repertano, eccezionale, nelle fessure degli oceani, nelle radici di alcuni legumi, nelle sorgenti d’acqua calda preferibilmente solforose, negli stagni ferrosi e presso gli impianti di depurazione.
I batteri aerobi crescono solo dove c’è ossigeno. Per il ricavo dell’energia si può parlare anche qui di respirazione cellulare, cioè in rapporto alla presenza di ossigeno, come si parla di respirazione polmonare per introdurre nel nostro organismo l’O2 con il processo dell’ematosi, dal quale si ricava energia (ATP) per la vita. Alcuni tipi possono causare problemi all’ambiente umano, come corrosione, incrostazioni, problemi di limpidezza dell’acqua e cattivi odori.
I batteri anaerobi si sviluppano solo in assenza di O2 e nell’uomo sono presenti principalmente nel
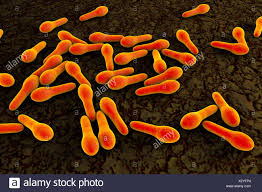
tratto gastrointestinale, colon soprattutto. Possono provocare coliti muco-emorragiche e necrotizzanti spesso fatali, gas (meteorismo), gangrena (infezione anaerobica di tessuto necrotico), tetano (dal Clostridium tetani), botulismo (dal GRAM+ Clostridium botulinum) sporigeno e la maggior parte delle parodontopatie (infezioni dentali). Esistono anche batteri anaerobi facoltativi che possono vivere cioè sia con/senza ossigeno. Si repertano nel suolo, nell’acqua, nella vegetazione e nella normale flora dell’uomo e degli animali, con un classico esempio, la Salmonella del tifo.
I batteri mesofili si riproducono in ambienti molto diversi quali il suolo, le acque dolci e di mare, gli scarichi fognari, gli animali, il corpo umano. La temperatura per il loro sviluppo è tra i 27 ed i 45°C., quella ottimale per molti mesofili patogeni è di 37 °C, e risultano nel novero dei responsabili della
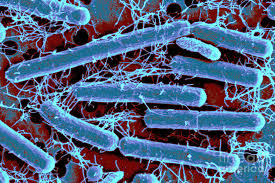
maggior parte delle infezioni umane. Ma molti di quelli innocui trovano importante utilizzo nella preparazione di cibi fermentati quali il formaggio e lo yogurt, nella produzione della birra e del vino. La flora intestinale umana, o microbioma intestinale (link), contiene batteri mesofili benefici, come (fonte) il Lactobacillus acidophilus.
La NUTRIZIONE: garantita la “benzina”, cioè l’energia come ATP che consente di vivere espletando le specifiche reazioni biochimiche, vediamo ora le loro modalità di nutrizione: si distinguono batteri autotrofi ed eterotrofi. Gli autotrofi sono in grado di sintetizzare le molecole organiche utilizzando come base di partenza dei composti inorganici, mentre gli eterotrofi riescono solo a metabolizzare composti organici che sono già stati sottoposti a precedenti processi di sintesi. La stragrande maggioranza dei batteri appartiene però al gruppo degli eterotrofi che può essere suddiviso in due grandi categorie, quella dei batteri saprofiti (che si cibano di materie vegetali e animali in via di decomposizione) e dei batteri parassiti (che si nutrono utilizzando il metabolismo di altri animali colonizzati). Per l’Uomo, utile questa classificazione: simbionti, a noi utili, commensali o saprofiti o indifferenti, opportunisti che possono diventare patogeni in determinate condizioni (solo in pazienti compromessi o se i germi vengono introdotti con procedure invasive) ed infine patogeni, capaci cioè di creare uno stato di malattia superando le difese immunitarie dell’organismo con compromissione del suo metabolismo.
Fissazione dell’azoto. I batteri assorbono azoto e quando muoiono lo rilasciano per l’impiego delle piante che ne hanno bisogno nel terreno per vivere. Molti semi di piante hanno un piccolo contenitore di batteri che viene utilizzato quando la pianta germoglia.
RIPRODUZIONE BATTERICA: capitolo complesso la cui organizzazione schematica, didattica è veramente difficile. Vediamo di renderla quanto più possibile “easy”. Ecco le modalità.
Fissione binaria: forma asessuale di riproduzione, nella quale una cellula continua a crescere fino a quando una nuova parete cellulare cresce dal centro, formando due cellule che si separano mantenendo lo stesso materiale genetico.
Trasferimento di materiale genetico: le cellule acquisiscono nuovo materiale genetico attraverso tre processi noti come (fonte):
coniugazione: trasferimento genico unidirezionale che richiede un contatto “fisico” tra due batteri sia nei Gram+ che Gram-, è il principale meccanismo di trasferimento di: geni per l’antibiotico-resistenza, geni codificanti per fattori di virulenza come (fonte) le enterotossine, esotossine proteiche prodotte da
alcuni particolari ceppi batterici GRAM+ come stafilococchi, vibrioni, clostridi ed altri, ad azione ovviamente tossica a livello della mucosa gastrointestinale, le adesine (fonte) anch’esse esostossine proteiche che si proiettano alla superficie del batterio consentendogli di aderire agli epiteli mucosi, colonizzandoli ed ancora l’enterobactina della famiglia dei siderofori (fonte), piccole molecole peculiari dei GRAM- e funghi, con elevata affinità per il ferro che viene chelato (reazione che ne impedisce l’assorbimento intestinale), con resistenza ad erbicidi, idrocarburi aromatici, metalli pesanti. La coniugazione rappresenta il principale meccanismo evolutivo/adattativo batterico; nei GRAM+ si ha la produzione e rilascio di ferormoni da parte della cellula “ricevente o accettrice” o femminile che inducono la produzione di una sostanza «aggregante» alla superficie della cellula “donatrice”, maschile, con formazione di aggregati cellulari e trasferimento del plasmide coniugativo. Plasmidi (fonte) elementi genetici capaci di replicazione autonoma con presenza extacromosomiale, costituiti da un doppio filamento di DNA chiuso circolarmente la cui replicazione avviene in modo analogo a quella del DNA cromosomiale. La stessa composizione ed aspetto di questo DNA lo troviamo nei desossiribovirus (link non ancora pronto del modulo n. 20).
trasformazione: (fonte) meccanismo di trasferimento genetico “evoluto” da una primitiva esigenza nutrizionale ed assunzione di frammenti di DNA solubile dall’ambiente circostante da parte di cellule
batteriche “competenti” GRAM+ e GRAM- (Bacillus, Haemophilus, Neisseria, Pneumococcus); con la trasformazione/donazione, il batterio donatore muore e si degrada. Anche qui, come per la coniugazione, è un meccanismo di trasferimento di geni per l’antibiotico-resistenza, per il trasferimento di geni codificanti per fattori di virulenza (enterotossine, adesine, siderofori), per il clonaggio di geni “utili” e per l’evoluzione/adattamento batterico;
trasduzione (fonte) consiste nel trasferimento di frammenti di DNA cromosomiale tra due batteri mediante un batteriofago (virus in grado di infettare elettivamente la cellula batterica inserendole il proprio genoma che si ricombina con il nucleoide o pseudonucleo batterico, cioè durante la replicazione fagica il DNA batterico viene inserito nel genoma fagico. Quindi morte per lisi del batterio e rilascio dei fagi nell’ambiente dove attaccano un batterio sensibile iniettandovi il proprio genoma: il ciclo continua. Questi tre complessi processi possono rendere i batteri più aggressivi, più forti e più capaci di resistere ad ambienti non favorevoli ed alle minacce, come gli antibiotici e possono ovviamente concludersi con la integrazione del DNA donatore in quello della cellula ricevente: è il fenomeno conosciuto come ricombinazione genica dove sono coinvolti enzimi responsabili della sintesi e del riparo del DNA con la generazione di variabilità genica, processo di riarrangiamento del DNA che porta alla fusione di frammenti appartenenti a molecole di DNA differenti, fondamentale processo evolutivo in quanto promuove nuove combinazioni di geni, permettendo un rapido adattamento alle condizioni ambientali, come prima sottolineato.
Riprendiamo il discorso: stiamo parlando della riproduzione batterica e continuiamo con le
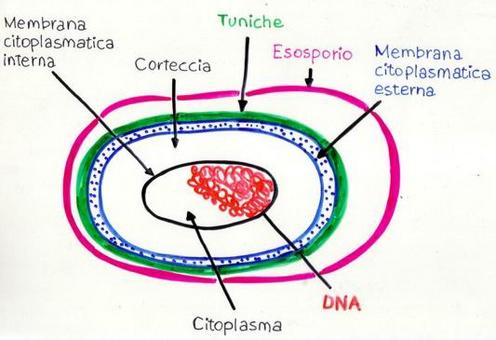
SPORE: sono cellule a tutti gli effetti, sia GRAM+ che G-, specializzate per la resistenza, ma inattive, stato denominato di criptobiosi (dal Gr. cripto, nascosto e bios, vita) cioè di vita latente in disidratazione, come i semi delle piante, che si formano quando alcuni tipi di batteri hanno poche risorse energetiche.
La loro struttura è rappresentata (fonte) da uno strato esterno, non sempre presente, detto esosporio, rappresentato da una membrana lipo-glico-proteica;
tuniche: diversi strati di natura proteica ricche dell’aminoacido cisteina simili alla cheratina, quindi molto resistenti;
membrana citoplasmatica esterna detta anche membrana plasmatica, plasmalemma o citomembrana è costituita da un doppio strato di fosfolipidi con polarizzazione da glicerolo ed apolare per gli acidi grassi, riveste il “core”, il centro metabolico della spora dei GRAM-, inoltre è la principale barriera osmotica della spora con permeabilità selettiva, consente l’apporto di nutrienti e lo smaltimento di cataboliti (prodotti di rifiuto), consente il metabolismo del glucosio e dell’ossigeno e la fotosintesi, quando necessario, con produzione ed impiego di ATP, è ancora sede dell’attività enzimatica di biosintesi per i lipidi di membrana e di altre molecole della parete cellulare batterica, peptidoglicano in primis, riconoscono infine i segnali ambientali per la chemiotassi (movimento di traslazione orientato da uno stimolo chimico, caratteristico degli elementi unicellulari);
corteccia, spesso strato di peptidoglucano e sali di calcio, già visto nella costituzione della parete batterica;
membrana citoplasmatica interna: molto più sottile di quella esterna, ha stessa composizione per lo più fosfolipidica;
citoplasma: presenta sali di calcio, enzimi, ribosomi, il DNA con genoma completo in grado di dare origine ad una cellula vegetativa ed in grande quantità proteine a basso peso molecolare, capaci di
interagire con il DNA proteggendolo dagli effetti delle radiazioni U.V. e di fornire una riserva di aminoacidi e di ATP, energia, per il processo di germinazione. Le spore trattengono il materiale del DNA e gli enzimi necessari per la germinazione, acquisiscono resistenza agli stress ambientali rimanendo inattive anche per secoli, fino a quando le giuste condizioni ambientali le riattivino per (ri)diventare batteri. Alcuni batteri producono endospore, o spore interne come il Clostridio, mentre altri producono esospore, rilasciate all’esterno. Esistono circa 100 specie di Clostridium, tra i quali il botulinum, responsabile di un tipo potenzialmente letale di intossicazione alimentare, il Cl. Tetani, il Cl. difficile, che causa coliti ma anche colite emorragica talora letale in corso di antibioticoterapia non supportata da somministrazione di adeguati fermenti lattici (patologia “fai da te” o iatrogena!) ed il C. perfrigens che provoca gangrena gassosa (gas di CO2, H+ ed acido solfidrico) con colliquazione dei tessuti, muscolari ed aponeurotici spesso nell’area ano-genitale, nelle incisioni chirurgiche e nelle lesioni traumatiche complesse “aperte”, spesso mortali. Cinque casi clinici nella mia esperienza, purtoppo mortali, uno soltanto post-chirurgico.
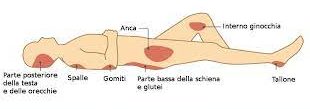
MODALITA’ di INGRESSO nell’UOMO: ben descrittiva in questa immagine per alcuni gruppi importanti di germi.

Affrontiamo ora le TOSSINE.
Sono antigeni per lo più di natura proteica, singole proteine o proteine organizzate come complessi oligomerici, che significa che sono formati da piccoli e brevi singoli frammenti di DNA o RNA.
Esse sono presenti in particolari batteri patogeni (patogeno: dal Gr. πάϑος, sofferenza, ma anche passione, emozione e -geno, generare) codificate (fonte) dai geni cromosomiali batterici, plasmidi (piccoli filamenti circolari di DNA superavvolto a doppia elica). Prima, nella riproduzione batterica, alla voce “trasformazione” abbiamo visto il compito dei batteriofagi o semplicemente fagi, virus che parassitano i batteri.
Le tossine sono di solito liberate dall’organismo dalla lisi (disgregazione della composizione biochimica della membrana cellulare e quindi sua rottura, da agenti biologici tipo enzimi, chimici e fisici), ma alcune sono eliminate con le vescicole ricche di proteine della membrana esterna nelle vescicole.
La loro VIRULENZA, cioè la capacità di provocare nell’ospite manifestazioni patologiche di varia entità supportate dalla replicazione batterica e dalla diffusione locale è di natura multifattoriale e per definizione una tossina innesca un processo distruttivo in vario modo (fonte), singolarmente come danno o con più fenomeni dannosi associati:
– inibisce la sintesi proteica (tossina difterica), attivando le vie del secondo messaggero (molecole con “funzione di regista” che permettono all’interno della cellula di agire con caratteristiche biochimiche peculiari di quella cellula) come per il Bacillus anthracis o la tossina del colera;
– attivano le risposte immunitarie (S. aureus superantigens, vedi avanti i superantigeni) o per azione generale dell’attività metalloproteasi (tossina Clostridium tetani). Da definire il significato di metalloproteasi, famiglia di enzimi in grado di degradare alcune proteine delle fibre della matrice extracellulare, come il collagene e l’elastina;
– danneggiano l’ospite nel sito di infezione o lontano dal loro ingresso (la tossina tetanica ed in misura minore, la tossina botulinica, ascendono assoni e colpiscono strutture neurologiche distanti) configurando la colonizzazione dell’ospite;
– agiscono come dispositivi molecolari autonomi combinandosi con recettori specifici sulla membrana superficiale, spesso composta da glicoproteine o gangliosidi (glicolipidi con acido sialico, derivato da un monosaccaride) alterandone la sua funzione (come l’emolisina dell’Escherichia Coli);
– penetrano nella cellula per raggiungere il loro bersaglio intracellulare praticando “buchi” o meglio “pori” (PFT: Pores Featuring Toxins) nelle loro membrane inserendosi come un’elica;
– possono ancora modificare componenti intracellulari di cellule specifiche di un organismo (tossine con attività intracellulari). Tutto ciò provoca permeabilità della membrana cellulare, squilibrio idro-ionico e morte della cellula.
Tra le 315 tossine proteiche indotte da batteri GRAM+ e GRAM- (fonte) finora caratterizzate, circa 50 sono attualmente considerate responsabili delle manifestazioni patologiche, e come visto, talora letali.
Le tossine batteriche si descrivomo in due grandi gruppi, funzione della loro liberazione dal corpo batterico, detta anche espressione biologica: ESOTOSSINE ed ENDOTOSSINE e a seconda dell’organo bersaglio caratteristico in enterotossine, neurotossine, citotossine, leucocidine ed (emo)lisine, qui con enzimi colliquativi che generano gangrena. Di queste, quella botulinica, è la più tossica al mondo.
Un singolo batterio produce spesso più di una tossina.
Un’importante tossina non proteica è il lipopolisaccaride (LPS), un’endotossina componente della parete cellulare dei batteri GRAM- che vedremo più avanti.
ESOTOSSINE: sono proteine extracellulari più o meno complesse, pertanto diffusibili, prodotte anche da alghe, funghi e protozoi, qui peculiari di ogni batterio dal punto di vista biologico e patogeno, diversamente dalle endotossine che vedremo più avanti.
Resistenti all’invecchiamento ed alla disidratazione, ma termolabili (con cottura o temperatura di almeno 80°C) sono prodotte dai germi Gram+, tranne per il bacillo G- di Shiga o Shigella dysenteryae; promuovono un’azione dannosa sia nel luogo di ingresso che nei siti colonizzati dove si replicano e la loro tossicità, essendo al di fuori, eso-, dei germi, la si può avere anche in loro assenza. La cellula bersaglio può essere unica, come il neurone per le tossine del tetano e del botulino, ovvero estesa ad elementi cellulari di vari organi, tessuti ed apparati come avviene con clostridi,
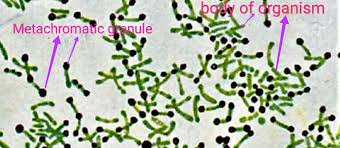
streptococchi, stafilococchi ed altri.
Il loro alto potere antigenico riconosciuto dai Linfociti B le rende vulnerabili agli anticorpi (sinonimo immunoglobuline, lo ricordo spesso) e sono anche trasformabili in anatossine (vedi avanti).
I più importanti batteri patogeni produttori di esotossine sono: i batteri del genere Clostridium responsabili del tetano, del botulismo e della gangrena gassosa, il Corynebacterium diphteriae, responsabile della difterite, gli stafilococchi produttori della tossina alfa, con espressione di emolisi e necrotizzante, alcuni ceppi di streptococchi beta-emolitici del gruppo A, classici delle tonsilliti e del reumatismo articolare acuto della prima metà del ‘900, (con severa compromissione sia renale glomerulare che della valvola mitralica, spesso fatali in giovani adulte/i), produttori di emolisine e della tossina causa dell’eruzione eritematosa della scarlattina, il bacillo di Shiga, Shigella dysenteriae della dissenteria bacillare, unico G-, già detto, produttore di tossina necrotizzante a carico della mucosa del colon.
Due i meccanismi d’azione: (fonte): fenomeni che vedremo anche per le endotossine:
– azione tossica sulla membrana cellulare (come abituale per il Clostridium Perfrigens) con conseguente distruzione della cellula ospite e l’ingresso con la
– penetrazione nella membrana citoplasmatica formando pori o canali (già prima nominati in VIRULENZA, con fuoriuscita di nutrienti e lisi della cellula come, ad esempio clinico, avviene per un’emolisina dello Streptococco e per quelle dello Stafilococco.
DENOMINAZIONE delle ESOTOSSINE: possono interessare l’intero organismo e vengono definite pantrope (dal Gr. pan, tutto e tropos, muoversi verso…) con la caratteristica di inibire la sintesi proteica dell’elemento cellulare aggredito. Lo vediamo con le
emolisine citolitiche che aggrediscono caratteristicamente soltanto le cellule di alcuni distretti;
enterotossiche soprattutto per le cellule mucosali del piccolo intestino (tenue) con vomito e diarrea per disregolazione talora mortale degli scambi idro-elettrolitici come per il Vibrione del colera (morte da disidratazione, potendo perdere fino a 5-7 l. di acqua/die!), le producono ancora il Clostridium perfrigens, l’Escherichia coli (“del colon” in Lat.), gli Enterobatteri, alcuni Stafilococchi e la Yersinia enterocolitica;
neurotrope: sono due, quella botulinica e quella tetanica. La prima attacca i neuroni del SNP inibendo la liberazione dell’acetilcolina (-> acetilcolina e -> neurotrasmettitori nel glossario etimologico) a livello della giunzione neuromuscolare con paralisi flaccida. L’aggettivo proviene dal Lat. botulus, salsiccia, è una tossinfezione alimentare determinata da un batterio Gram+ anaerobio obbligato, il Clostridium botulinum che può contaminare alimenti. La neurotossina provoca paralisi respiratoria: è quindi un esempio di morte per ipossia ipossica (modulo n. 3, lezione n. 11 ) inibendo il rilascio dei neurotrasmettitori a livello sinaptico, preceduto da un rapido ed evolutivo quadro di gastroenterite. Definizione presa nel glossario etimologico di Neurologia, alla parola “botulismo”.
La seconda, l’esotossina tetanica citolitica, attacca invece il SNC con blocco della liberazione dei neurotrasmettitori inibitori e quindi paralisi spastica;
citotossiche o citolitiche o citolisine o tossina emolitica: già visto che sono pantrope, formano pori con alterazione del citoplasma, inibizione delle sintesi proteiche e morte cellulare; esse aumentano la virulenza di un ceppo batterico. Ne sono esempi quelle dello Stafilococco aureus agente nelle tossinfezioni alimentari spesso con i drammatici superantigeni (vedi avanti), nei foruncoli e nell’acne; le emolisine, con lisi dei globuli rossi (cardiotossiche, vedi avanti) e quindi fuoriuscita dell’Hb ed ancora la streptolisina; la suddetta tetanolisina, l’emolisina stafilococcica e la emolisina dell’Escherichia Coli. Altre
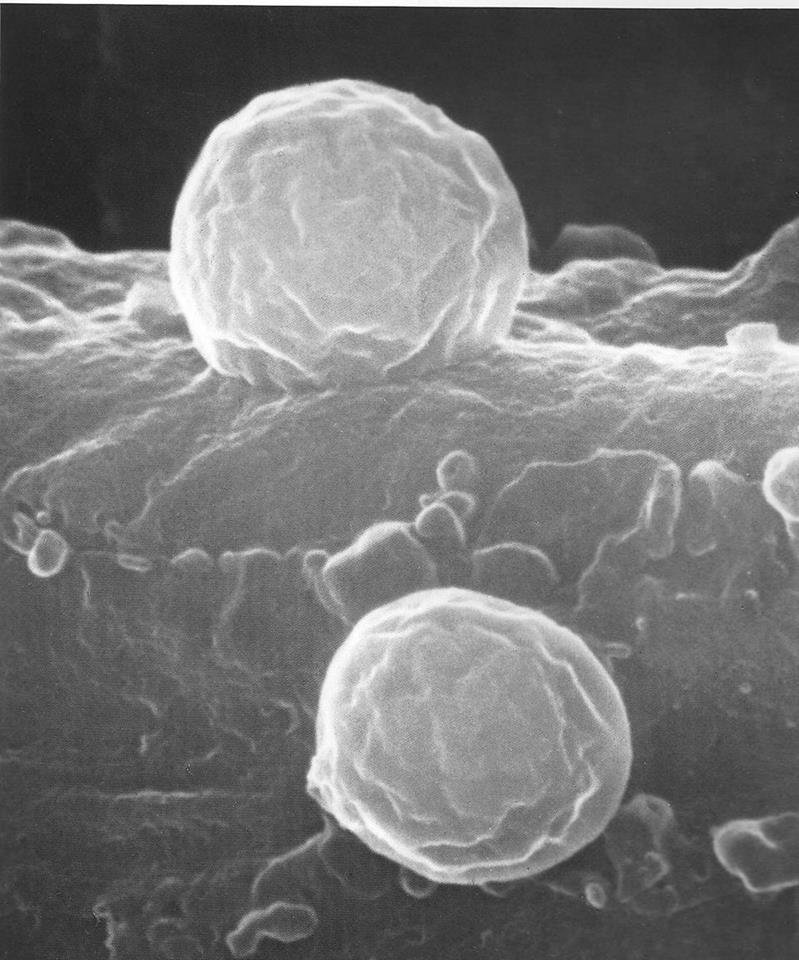
tossine citotossiche, come quelle della Listeria monocytogenes, hanno la capacità di aggredire globuli bianchi, come i fagociti macrofagi, che ricordo essere monociti attivati dai batteri di origine dalla linea mieloide midollare (lezione n. 5 del modulo 2);
nefrotossiche: (fonte) lo Stafilococco aureus può provocare infezioni in tutto l’organismo con la sua batteriemia, soprattutto cute (con oltre il 70% delle infezioni da pelle), endocardite, (come lo Streptococco pyogenes), polmonite necrotizzante potenzialmente letale e sindrome da shock tossico con la classica insufficienza renale acuta. Problemi aggravati dalle specie meticillino-resistenti con la sigla di MRSA (Methicillin-Resistant Staphylococcus Aureus) presenti sia in ambito ospedaliero con il 60% delle infezioni nelle unità di terapia intensiva, che sul territorio. Si stima che le sole infezioni da MRSA invasive causino circa 19.000 decessi ogni anno negli USA, il che è simile al numero totale di decessi dovuti a AIDS, TBC ed epatiti virali combinati (fonte);
(mio)-cardiotossiche: soprattutto da Streptococco pyogenes (fonte);
epatotossiche, gruppo citotossiche: soprattutto da Stafilocco aureus, con i suoi superantigeni tossici pirogeni e le emolisine;
ciliostatiche: agiscono sugli epiteli con cilia (ciglie) come quelli delle mucose tracheo-bronchiolari, inibendone il movimento, favorendo così la colonizzazione dei germi, come avviene con la tossina della Bordetella pertussis, della pertosse; stesso epitelio nelle tube di Falloppio, ma non invase perchè la via di contagio è inalatoria!!!![]()
Tossine come SUPERANTIGENI: sono molecole proteiche prodotte da batteri e virus come meccanismo di difesa contro il sistema immunitario dell’ospite, capaci di attivare un’abnorme produzione di linfociti T. Ecco come: gli antigeni convenzionali (fonte) attivano uno o al più pochissimi cloni di linfociti T (CD4+); vengono captati da monociti che -> macrofagi, dai linfociti B che li elaborano e li presentano ai linfociti T helper specifici che vi si legano provocandone l’attivazione. I superantigeni invece si legano aspecificamente ai monociti ed attuano una superstimolazione di numerosi cloni T, come detto all’inizio, con massiccia stimolazione infiammatoria per una formidabile ed intensa produzione di citochine (vedi in fondo alla lezione) la più importante delle quali è l’interferone gamma (IFN-γ) che attiva i macrofagi che producono eccessivamente altre molecole di citochine pro-infiammatorie come IL-1, IL-2, Il6 e TNF-alfa e rischio di shock e MOF (Multi-Organ Failure) cioè insufficienza funzionale multi-organo altamente letale; ed ancora febbre (vedremo avanti la dinamica biochimica nella pirogenicità, sovrapponibile a quella delle endotossine), ipercatabolismo proteico, shock emodinamico con scompenso del sistema immunitario e spesso morte del Paziente: è la sindrome da shock tossico nonché della intossicazione alimentare.
Le tossine superantigeni vengono prodotte da un numero crescente di batteri, tra i quali lo Staphylococcus aureus e specie di Streptococcus con conseguenze cliniche pesantissime in quanto, come visto, colpiscono il sistema immunitario innato o aspecifico (senza esposizione antigenica e quindi immunità naturale, ereditaria o costitutiva sono sinonimi) che rappresenta la prima linea di difesa e filogeneticamente più antica degli individui, degli animali e delle piante.
Esso è costituito dai Linfociti NK (Natural killer di provenienza dai Linfociti B stimolati, fagociti della linea midollare linfoide derivati dai Linfociti B, dai granulociti eosinofili e basofili, dai fagociti della linea mieloide come i monociti -> macrofagi, dai granulociti neutrofili ed ancora dai mastociti. Vedi le linee midollari delle cellule del sangue (modulo n. 2, lezione n. 3).
ANATOSSINE: esotossine che hanno perso la proprietà di comportarsi come sostanze nocive, conservando invece quella di antigene; da qui la potenzialità di stimolare la reazione anticorpale dell’ospite, utile nei programmi di vaccinazione, laddove possibile.

ENDOTOSSINE: si trovano sulla parete cellulare dei batteri G.-, già viste prima parlando della loro membrana batterica esterna, molecole resistenti agli agenti chimici e fisici, termostabili all’autoclave (15’ a 121 °C) che si riassumono nel già nominato lipopolisaccaride (LPS), liberato alla morte del batterio in modesta concentrazione dai germi in crescita o da quelli lisati a causa di efficaci meccanismi di difesa dell’ospite o dalle attività di alcuni antibiotici ed in quantità pericolose ed anche letali se non dominati.
La loro resistenza ai vari agenti fà sì che le si possano trovare negli alimenti, farmaci, materiale organico (allevamenti, macellazione, trattamento di acque reflue e di rifiuti organici ecc.) come frequenti microinquinanti ambientali ed atmosferici per ingestione, ma soprattutto per inalazione, intuitivamente in molti posti di lavoro e nelle abitazioni con scarsa igiene.
Le endotossine risultano più pericolose delle esotossine.
Il LPS, in piccole quantità attiva i monociti che -> macrofagi e molti mediatori dell’infiammazione; il LPS assorbito quotidianamente in modeste quantità stimola positivamente il sistema immunitario (fonte) essendo i batteri G.- parte della flora microbica intestinale normale e quindi piccole quantità di LPS sono sempre assorbite, ma in quantità elevate questa endotossina, per la quale gli anticorpi non hanno effetto sul potere tossico, generano o possono favorire effetti comuni come: febbre (pirogenicità), attivazione del complemento (vedi avanti) e della trombosi (coagulazione patologica, vedi avanti), batteriemia e la colonizzazione dei tessuti profondi, cioè dei visceri.
Pirogenicità: è la capacità di indurre febbre da parte dei macrofagi (ricordo che sono monociti attivati) che liberano mediatori cellulari, fra i quali TNFα (Tumor Necrosis Factor alfa), IL1 (InterLeuchina 1), IFN (Interferone), tutte citochine a potente azione infiammatoria (problematiche già viste prima, in “superantigeni”) con molte ripercussioni che raggiungono l’ipotalamo stimolato a produrre prostaglandine (vedi avanti) e quindi febbre, alterando in eccesso la temperatura ritenuta “normale”. Il danno ulteriore di queste citochine (vedi a fine endotossine) pro-infiammatorie è qui elencato.
Attivazione del Complemento. Il sistema del complemento è costituito (fonte) da una dozzina di proteine circolanti, per lo più prodotte dal fegato e dai loro recettori di membrana, capaci di interagire sia tra di loro che con le membrane cellulari: è questo un compito fondamentale dell’immunità innata (vedi prima a “superantigeni”), naturale e filogeneticamente antica, e di quella acquisita, più recente, per l’innesco della risposta protettiva in rapporto ai batteri patogeni. Se l’intensa formazione dei predetti pori sovrasta le possibilità di riparazione cellulare, il liquido extra-cellulare penetra per gradiente osmotico e fà “scoppiare” la cellula con rilascio del contenuto intracellulare nell’interstizio connettivale e
quindi flogosi. Accanto al complemento, la funzione delle
opsonine, macromolecole favorite dalla attivazione del complemento con la formazione preferenziale delle IgG. Esse rendono riconoscibili gli immunocomplessi (sinonimo complesso antigene-anticorpo), da parte dei recettori dei macrofagi per un componente dell’anticorpo (Ig) stesso: ciò favorisce (fonte) la captazione del germe con esaltazione della loro capacità fagocitaria. Da qui l’eliminazione finale dell’Ag (antigene). Gli immunocomplessi quando precipitano nei tessuti e soprattutto sull’endotelio o nella parete vasale, provocano reazioni infiammatorie dannose, classiche le artralgie da sindrome influenzale, ma anche dannosissime, come vasculiti, glomerulonefriti e la sclerodermia.
Infiammazione, immunità e complemento sono legati anche da un punto di vista genetico-evoluzionistico, come si evince dalla organizzazione dei geni sul cromosoma 6.
Attivazione della trombosi o coagulazione patologica con possibilità di trombi negli ambiti più disparati con la severa e talora fatale CID (Coagulazione Intravascolare Disseminata). Al modulo 3, lezione n. 11 vi ricordo l’Amico R. Virchov con la sua preziosa triade della trombofilia. Ricordo la microtrombosi dei capillari alveolari polmonari in corso di Covid-19 con compromissione dell’ematosi.
Vasodilatazione periferica per > della permeabilità dei capillari e pertanto edema, soprattutto polmonare, miocardico, renale e cerebrale. Da qui
stasi ematica con ipossia stagnante (venosa), ipotensione, fino allo shock emodinamico.
Aumento del metabolismo proteico sproporzionato con effetti catabolizzanti (consumo estremo di proteine o massa magra, come fonte di ATP, energia) , acidosi metabolica (vedi in fondo) ed iperstimolazione come superantigeni dei linfociti T descritta prima nelle esotossine, ma inefficace, anzi deleteria. Ricordo che il compito dei Linfociti T, compromessi soprattutto in caso di HIV, è quello di attivarsi in caso di infezioni virali, micotiche e da TBC.
Alcune definizioni come prima promesso.
CITOCHINE: (dal Gr. cito- e kínēsis,‘movimento), sono piccole proteine talora con carattere di ormone, prodotte da varie cellule ed immesse nell’interstizio (fonte) che si legano a specifici recettori di membrana cellulare alla quale comunicano stimoli alla mitosi, a differenziarsi o a morire (apoptosi). La loro kínēsis si attua muovendosi verso i siti di infiammazione, infezione e trauma. Se ne osservano 4 gruppi:
le emopoietine, includono fattori di crescita come l’eritropoietina (Epo, ormone renale che stimola il midollo rosso, osseo, a produrre globuli rossi come ricambio fisiologico, in corso di anemie e di ipossie ipossiche) e diverse interleuchine prodotte dai Leucociti;
le chemochine anch’esse prodotte dai leucociti, con le interleuchine svolgono un ruolo fondamentale nella regolazione e nell’attivazione dei meccanismi di difesa (fagocitosi e produzione di anticorpi) e nei processi infiammatori;
il fattore di necrosi tumorale (TNFα): ne ho parlato oltre 10 anni fa in un articolo dedicato nella “obesità”, ma torna utile far riflessione adesso in campo infettivologico dove lo troviamo attivo nelle infiammazioni sistemiche acute, prodotte per lo più dai macrofagi (monociti attivati), ma anche in modesta concentrazione, anche dal resto dei globuli bianchi e dai mastociti;
gli interferoni (IFN): sono glicoproteine solubili che inducono le cellule a resistere agli attacchi virali soprattutto con i linfociti T, favoriscono l’inibizione della crescita cellulare (effetto antimitogeno) anche in campo Oncologico, hanno effetti immunosoppressori, di potenziamento dei macrofagi, dei linfociti natural killer (NK, macrofagi di derivazione dai linfociti B), ancora della fagocitosi dei granulociti neutrofili ed infine attività che promuovono la differenziazione cellulare e quindi della funzione specifica. L’IFN è anche coinvolto nella patogenesi di varie malattie: del collagene come il Lupus eritematoso sistemico (LES) e l’artrite reumatoide, del diabete mellito I.D., dell’epatite fulminante e della pancreatite necrotico-emorragica, della nefrite, della sclerosi multipla (SM), delle malattie allergiche e dell’aterosclerosi. Allo stato attuale, l’IFN è clinicamente utilizzato nella terapia delle infezioni da HBV ed HCV, nel carcinoma renale, glioblastoma, linfoma maligno e leucemia mieloide cronica, melanoma maligno, mieloma multiplo (tumore delle plasmacellule di derivazione dai linfociti B), tumori della cute.
Tre tipi di IFN:
interferoni (IFN) alfa: il preciso funzionamento dell’interferone alfa non è ancora chiaro, ma ci sono evidenze che possa aiutare il sistema immunitario attivando i linfociti nella lotta contro i virus e contro le cellule tumorali, indotte a diminuire la mitosi.
IFN beta: anche qui incertezze sui reali comportamenti della molecola, ma sembra utile nella strategia terapeutica delle forme acute e recidivanti di sclerosi multipla, per ridurne il numero delle recidive e per ritardare l’aggravarsi clinico dei Pazienti. Sembra provenire dai fibroblasti e dalle cellule epiteliali sotto stimolo virale.
IFN gamma: prodotto dai linfociti T attivati e linfociti NK in risposta ad alcune interleuchine. Presenta attività immuno-modulante ed ha bassa attività antivirale.
Acido arachidonico: parto da quest’acido per parlare di altro, essendo un componente fondamentale dei fosfolipidi della membrana cellulare e ad espressione biochimica estremamente versatile. Da questo acido, (fonte) in risposta ad agenti ormonali ed a stimoli chimici o fisici si formano prostaglandine, acidi grassi insaturi, leucotrieni, importanti mediatori del processo infiammatorio ed endoperossidi che a loro volta formano prostaglandine, prostacicline (di derivazione dalle prostaglandine), reperibili soprattutto sulla parete endoteliale dei vasi, hanno effetti opposti a quelli dei trombossani, di natura lipidica, inibendo l’aggregazione piastrinica e determinando vasodilatazione.
Endoperossido: è una prostaglandina-enzima che catalizza la conversione di acido arachidonico in endoperossido prostaglandinico e quindi nelle successive molecole, quasi ad effetto domino.
Acidosi metabolica: qui parliamo di equilibrio acido-base che richiede un prelievo di sangue arterioso denominato EGA (EmoGasAnalisi), dall’arteria radiale al polso, o come spesso facevamo noi in Chirurgia, dall’arteria femorale all’inguine.
5 i referti all’EGA: normalità, acidosi metabolica, acidosi respiratoria, alcalosi metabolia ed infine alcalosi respiratoria. Discorso estremamente complesso che cercherò di farmi esporre da un’Amica/Amico Anestesista-Rianimatore. Per ora vi dico soltanto che l’acidosi metabolica con pH < 7.10, è un problema sindromico (ricordo: un insieme di segni e sintomi) con la primaria < del bicarbonato (HCO3−) quindi < della pCO2 (iperpnea compensatoria per eliminare CO2 a valenza acida) dove i rapporti degli elettroliti + come il Na+ e quelli -, come il Cl- e l’HCO3-, sono sbilanciati a favore degli ioni +. Ciò si osserva essenzialmente: nella chetoacidosi nel diabete mellito di tipo 1 e 2, mal/denutrizione con mancato accesso alla alimentazione in primo piano (Paesi poveri) e quindi alcolismo cronico, dieta prolungata prettamente proteica (le diete Plank e Dukan dall’alito acetonemico insopportabile che non apprezzo, ma vi dico il perchè, peraltro intuitivo), digiuno prolungato, > dell’acido lattico (C3H6O3) che ricordo, nelle ipossie ischemiche (lezione n. 11, modulo n. 3) da IMA o emorragie severe, richiede un metabolismo anaerobico con produzione dal glucosio di 2 molecole di acido lattico e basso ATP, invece di H2O, CO2 e molto ATP, nello shock di vario tipo (l’IMA e le emorragie predette sono ovvie), nella severa insufficienza renale per < escrezione (III° funzione del nefrone) di acidi e di riassorbimento di ioni bicarbonato (HCO3-), nei politraumi con lesioni complesse dell’apparato muscolare, nell’assunzione volontaria o accidentale di acidi, nella diarrea protratta, tipo colera, dissenteria bacillare o nella drammatica abitudine degli anoressici di assumere catartici (lassativi) in grandi quantità ripetute con perdita di acqua, bicarbonati e SALUTE!!!
ANTIBIOTICI, cenni.
Prima di parlare degli antibiotici, con etimologia dal Gr. antibiosis, anti- -bio, contro la vita (dei batteri), ricordo due definizioni che fanno peraltro parte del quotidiano del personale sanitario:
antisettici, prodotti della biochimica utilizzati per sterilizzare le superfici dei tessuti viventi quando il rischio di infezione è elevato, come prima e durante un intervento chirurgico o invasivo, nelle piaghe, ulcere e ferite; e
disinfettanti, antimicrobici non selettivi che uccidono una vasta gamma di microrganismi, compresi i batteri. Sono utilizzati su superfici non viventi, ad esempio negli Ospedali. Oltre ai batteri ovviamente, ci sono anche miceti e virus che possono rappresentare un pericolo per l’uomo per i quali sono previsti rispettivamente farmaci antifungini e antivirali.
Solo le sostanze che colpiscono i BB sono chiamate antibiotici, la maggior parte dei quali sono prodotti
in laboratorio, ma già rilevati in natura; alcuni sono altamente specializzati, efficaci solo contro alcuni batteri, altri noti come antibiotici ad ampio spettro, attaccano una vasta gamma di batteri, compresi quelli che ci sono utili (link).
Essi, già detto, non hanno azione sui virus (la prossima lezione n. 44) link in preparazione.
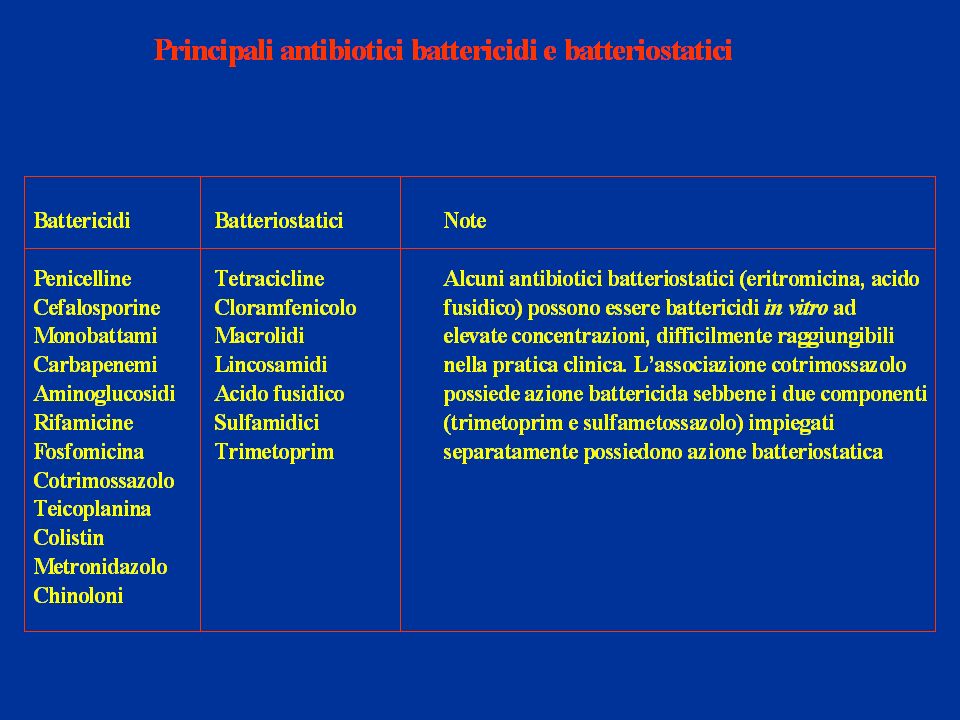
Gli antibiotici vengono definiti in due gruppi, a seconda della modalità di effetto sui batteri:
battericidi, cioè uccidono i BB bloccando il meccanismo responsabile della costruzione delle loro pareti cellulari, come con la Penicillina e le Cefalosporine, oppure impedendo crescita, espansione e divisione della parete per la mitosi, “indurendola”, come avviene per i nuovi glicopeptidi come la corbomicina e la complestatina (fonte del 12.02.2020), preziose nella terapia dell’MRSA (Staphylococcus aureus resistente ai farmaci-Meticillina);
batteriostatici quando sono in grado di contrastare la riproduzione dei batteri impedendo ai nutrienti di raggiungerli, con loro impossibilità di crescere, riprodursi e quindi di “vivere”; ciò avviene con la Tetraciclina e l’Eritromicina.
Fermando o ritardando l’infezione, si dà tempo al sistema immunitario, che ricordo essere fagocitosi e produzione di anticorpi, di organizzarsi e quindi di reagire.
 daddydoctorgym.com il sito dove trovare alcuni consigli per il buon uso della palestra e la donazione di sangue
daddydoctorgym.com il sito dove trovare alcuni consigli per il buon uso della palestra e la donazione di sangue



8 commenti
Pingback: Scienze Infermieristiche e Corso OSS Dierreform: programma di Medicina, Dr. Stefano Graziani - daddydoctorgym.com
Pingback: Scienze Infermieristiche e Corso OSS. Modulo n. 20, lezione n. 44: Virus - daddydoctorgym.com
Pingback: Scienze Infermieristiche e Corso OSS: modulo n. 21, lezione n. 45: Funghi (Miceti), Clinica delle Micosi - daddydoctorgym.com
Pingback: Scienze Infermieristiche e Corso OSS DierreForm. Modulo 22, lezione n. 46: Coronavirus in epoca di quarantena. - daddydoctorgym.com
Pingback: Scienze Infermieristiche e Corso OSS DierreForm. Riassunto, cenni sulle lezioni: Batteri, Virus, Miceti.Modulo n. 23, lezione n. 47 - daddydoctorgym.com
Pingback: Dio non gioca a dadi - daddydoctorgym.com
Pingback: Dio non gioca a dadi con l'Universo! - daddydoctorgym.com
Pingback: Nuovo Corso OSS: cenni di Pediatria. Modulo n. 4/nc - daddydoctorgym.com